
| A. | 在0.1mol/LNaHCO3溶液中:Al3+、NH4+、SO42-、NO3- | |
| B. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液中:K+,Cl-,Fe2+,NO3- | |
| C. | 使甲基橙变红的溶液中:NH4+,Cl-,SO2-,Mg2+ | |
| D. | 25℃时,水电离出的c(H+)=1×10-13mol/L:K+,Ba2+,NO3-,S2- |
分析 A.铝离子与碳酸氢根离子发生双水解反应;
B.该溶液中存在大量氢氧根离子,亚铁离子与氢氧根离子反应;
C.使甲基橙变红的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
D.该溶液中存在大量氢离子或氢氧根离子,硫离子与氢离子反应,硝酸根离子在酸性条件下具有强氧化性,能够氧化硫离子.
解答 解:A.NaHCO3、Al3+之间发生双水解反应,在溶液中不能大量共存,故A错误;
B.该溶液呈碱性,Fe2+与碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.使甲基橙变红的溶液中存在大量氢离子,NH4+、Cl-、SO42-、Mg2+之间不反应,都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.25℃时水电离出的c(H+)=1×10-13mol/L的溶液呈酸性或碱性,S2-与氢离子反应,NO3-在酸性条件下能够氧化S2-,在酸性溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
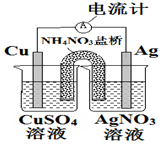
| A. | 盐桥中的NH4+离子向左侧烧杯移动 | |
| B. | 铜电极上发生的反应为Cu-2e-═Cu2+ | |
| C. | 外电路中的电子是从银电极流向铜电极 | |
| D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是部分短周期元素的原子序数与其某种常 见化合价的关系图,若用原子序数代表所对应的元素,则下列说法中不正确的有( )
如图是部分短周期元素的原子序数与其某种常 见化合价的关系图,若用原子序数代表所对应的元素,则下列说法中不正确的有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 增大体积 | C. | 加负催化剂 | D. | 补充 He |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
| 第一次试验 | x(HI) | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
| 第二次试验 | x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol Mg与足量盐酸反应生成氢气的体积为11.2升 | |
| B. | 标准状况下,11.2L SO2所含的原子数为1.5NA | |
| C. | 8gCH4所含的氢原子数为0.5NA | |
| D. | 46g NO2和N2O4的混合物所含的分子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com