
【题目】根据要求回答下列问题:
I. ①H、D、T ②H2O、D2O ③石墨、金刚石 ④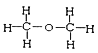 和
和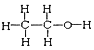
四组微粒或物质中,互为同位素的是_______;(填序号,下同)互为同素异形体的是_____。
II.现有①金刚石 ②干冰 ③Na2SO4 ④NH4Cl 四种物质,按下列要求回答:
(1)晶体熔化时需要破坏共价键的是_____(填序号,下同);
(2)熔点最低的是_______
(3)晶体中只存在一种微粒作用力是_______;
(4)属于离子晶体的是________。
【答案】 ① ③ ① ② ① ③④
【解析】I.同位素:质子数相同,中子数不同的同一元素不同原子互称,符合题意的是①;同素异形体:同种元素组成不同结构的单质,符合题意的是③;同分异构体:分子式相同,结构不同,属于同分异构体是④;H2O、D2O是由同种元素组成,为同一种物质;正确答案:①;③。
(2)①金刚石属于原子晶体,碳原子之间通过共价键结合,熔点高,熔化时破坏共价键;②干冰属于分子晶体,分子间存在分子间作用力,碳原子与氧原子之间存在共价键,熔点低,熔化时破坏分子间作用力;③Na2SO4属于离子晶体,钠离子与硫酸根离子通过离子键结合,硫原子与氧原子之间存在共价键,熔点较高,熔化时破坏离子键;④NH4Cl属于离子晶体,氨根离子与氯根离子通过离子键结合,氮原子与氢原子之间存在共价键,熔点较高,熔化时破坏离子键和共价键;
(1)综上所述,晶体熔化时需要破坏共价键的是①;正确答案:①。
(2)综上所述,熔点最低的是②;正确答案: ② 。
(3)综上所述,晶体中只存在一种微粒作用力是①;正确答案:①。
(4)属于离子晶体的是③④;正确答案:③④。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______
(2)D元素位于周期表中___________周期____________族
(3)写出AB2与C2B2反应的化学方程式:________________________________________。
(4)电子式表示化合物 C2D 的形成过程:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2molSO2和1molO2充入2L密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ/mo!,下列说法中正确的是
2SO3(g) △H=-197kJ/mo!,下列说法中正确的是
A. 反应达到平衡状态时,会放出197kJ的热量
B. 增大O2浓度可以使SO2转化率达到100%
C. 使用合适的催化剂、升高温度均可加大反应速率
D. 反应达到平衡时,正反应和逆反应的化学反应速率相等且不为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2SO3·CuSO3·2H2O是一种深红色固体(以下用M表示)。某学习小组拟测定胆矾样品的纯度,并以其为原料制备M。
已知:①M不溶于水和乙醇,100℃时发生分解反应;
②M可由胆矾和SO2为原料制备,反应原理为3Cu2++6H2O+3SO2![]() Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
I.测定胆矾样品的纯度。
(1)取w g胆矾样品溶于蒸馏水配制成250mL溶液,从中取25.00mL于锥形瓶中,加入指示剂,用c mol·L-1EDTA(简写成Na4Y)标准溶液滴定至终点(滴定原理:Cu2++Y4-====CuY2-),测得消耗了V mL EDTA标准溶液。则该胆矾样品的纯度为____________%(用含c、V、w的代数式表示)。如果滴定管装液前没有用EDTA标准溶液润洗,测得的结果会_________ (填“偏高”“偏低”或“无影响”)。
Ⅱ.制备M。实验装置如下图所示:

(2)实验室用70%硫酸与亚硫酸钠粉末在常温下制备SO2。上图A处的气体发生装置可从下图装置中选择,最合适的是________(填字母)。

(3)装置D中的试剂是____________。装置B中水浴加热的优点是____________________。
(4)实验完毕冷却至室温后,从锥形瓶中分离产品的操作包括:__________、水洗、乙醇洗、常温干燥,得产品Cu2SO3·CuSO3·2H2O。检验产品已水洗完全的操作是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为( )
A.920kJ
B.557kJ
C.436kJ
D.181kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)天然气和可燃冰(mCH4nH2O)既是高效洁净的能源,也是重要的化工原料。
①可燃冰(mCH4nH2O)属于_____晶体,写出CH4的结构式______。
②已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.65kJ热量,则该条件下反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的 △H=___kJ/mol。
(2)用甲烷--氧气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。反应装置如下图所示:

①b电极名称为______,d电极的电极反应式为__________。
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,理论上燃料电池消耗的氧气在标准状兄下的体积是_______mL。
(3)25℃,101kPa条件下,14gN2和3gH2反应生成NH3的能量变化如下图所示:
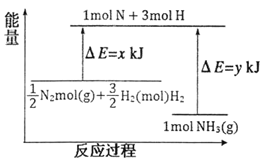
已知:①x=1127;
②25℃,101kPa下,N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJmol-1。则y=______。
2NH3(g) △H=-92kJmol-1。则y=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应Zn+H2SO4===ZnSO4+H2↑,下列叙述正确的是( )
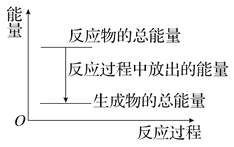
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则锌作正极
D. 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com