
| 温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
| K/(×10-8 mol3•L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
| A. | 若Z的体积分数不再随时间变化时表示反应达平衡状态 | |
| B. | 35 oC时,达平衡时,X分解了 0.03 mol | |
| C. | 该反应在高温下可能自发 | |
| D. | 若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大 |
分析 A、反应X(s)?2Y(g)+Z(g)中,Y和Z都是气体,而X是固体,所以Z的体积分数始终不随时间变化而变化;
B、根据三行式,结合平衡常数,求平衡时各组分的物质的量;
C、由表可知温度越高,平衡常数K越大,所以反应X(s)?2Y(g)+Z(g)△H>0,△S>0,根据△G=△H-T△S分析解答;
D、压缩容器体积,相当于增大压强,平衡逆向移动.
解答 解:A、反应X(s)?2Y(g)+Z(g)中,Y和Z都是气体,而X是固体,所以Z的体积分数始终不随时间变化而变化,所以Z的体积分数不能作平衡状态的标志,故A错误;
B、35℃平衡常数为10.8,
X(s)?2Y(g)+Z(g),
起始量:a 0 0
变化量:b 2b b
平衡量:a-b 2b b
所以K=$(\frac{2b}{10})^{2}×\frac{b}{10}$=10.8,解之得b=0.03 mol,故B正确;
C、由表可知温度越高,平衡常数K越大,所以反应X(s)?2Y(g)+Z(g)△H>0,△S>0,根据△G=△H-T△S,只能在高温的条件下反应能自发进行,故C正确;
D、压缩容器体积,相当于增大压强,平衡逆向移动,所以再次达平衡后,n(X)比原平衡大,故D正确;
故选A.
点评 本题考查了化学反应的计算和化学平衡的有关知识,注意理解化学平衡状态的判断,侧重于基本原理的应用,题目难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
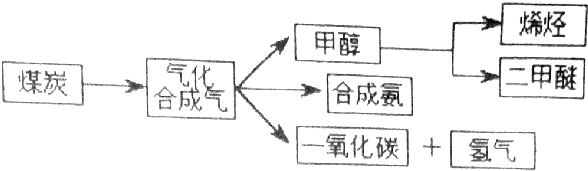
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
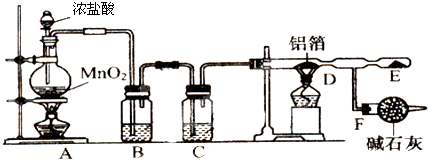
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| U | |||
| W | Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容,充入NO2气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 8:1 | C. | 2:5 | D. | 5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
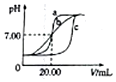 某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )
某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )| A. | 乙组同学操作上的不足是在滴定终点附近测试和记录pH的间隔太大 | |
| B. | 甲组同学滴定时选用的滴定管为酸式滴定管 | |
| C. | 乙和丙两组同学的操作均存在不足或失误 | |
| D. | 丙组同学可能是用待测液润洗了锥形瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com