
һ�������£�����[CO(NH2)2]��NO��Ӧ����N2���� ��2�ֶԻ�������Ⱦ���������ͼ�� CO(NH2)2��ij��������NO�����ʵ���֮�ȷֱ�Ϊ1:2��2:1��3:1ʱ��NO�ѳ������¶ȣ�t���仯��ͼ������˵���������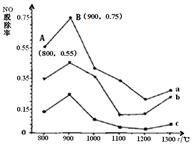
| A�������ѳ�NO�ķ�ӦΪ��2CO��NH2��2 + 6NO��2CO2 + 4H2O + 5N2 |
| B��ͼ��a����ӦCO(NH2)2��NO�����ʵ���֮��Ϊ1:2 |
| C����900�����ң�NO���ѳ������ |
| D��NO����ʼŨ��Ϊ6��10-4 mg / m3��ͼ��a��A�㵽 B�㾭��0.8 s�����ʱ����NO���ѳ�ƽ������Ϊ1.5��10-4 mg / (m3��s) |
B
�������������A�����������������غ㶨�ɿ�֪�������ѳ�NO�ķ�ӦΪ�� 2CO��NH2��2 + 6NO��2CO2 + 4H2O + 5N2����ȷ��B.����ͬ�¶��£�a��Ӧ��NOת������ߣ������Ŀ�ṩ���ſ�֪Ӧ��CO(NH2)2��NO�����ʵ���֮��Ϊ3:1�����������C����ͼ����Կ�������900�����ң����������ֻ�ϱ�����NO���ѳ�����ߡ���˸��¶�������¶ȡ���ȷ��D��NO����ʼŨ��Ϊ6��10-4 mg / m3��ͼ��a��A�㵽 B�㾭��0.8 s�����ʱ����NO���ѳ�ƽ������Ϊ6��10-4 mg / m3��(0.75-0.55)��0.8s=1.5��10-4 mg / (m3��s).��ȷ��
���㣺����CO(NH2)2��ij��������NO��ӦNO�ѳ������¶ȡ����ʵ����ıȵĹ�ϵ��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���淴ӦmA(g)��nB pC(g)��qD�У�A��C������ɫ���壬�ﵽƽ�������������ȷ����
pC(g)��qD�У�A��C������ɫ���壬�ﵽƽ�������������ȷ����
A��������B������ƽ����ϵ��ɫ���˵��B��������
B������ѹǿ��ƽ�ⲻ�ƶ���˵��m��nһ������p��q
C�������¶ȣ�A��ת���ʼ�С��˵������Ӧ�����ȷ�Ӧ
D����B�����壬����A������A��B��ת���ʶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ͼ�ǿ��淴ӦX2 + 3Y2 2Z2�ڷ�Ӧ�����еķ�Ӧ���ʣ��ԣ���ʱ�䣨t���Ĺ�ϵ���ߣ�
2Z2�ڷ�Ӧ�����еķ�Ӧ���ʣ��ԣ���ʱ�䣨t���Ĺ�ϵ���ߣ�
����������ȷ����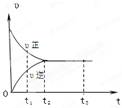
| A��t1ʱ��ֻ��������Ӧ | B��t2ʱ����Ӧ������ |
| C��t2~ t3����Ӧ���ٷ��� | D��t2~t3�������ʵ�Ũ��һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���и����������ķ�Ӧ����Ӧ�տ�ʼʱ���ų�H2�����������ǣ� ��
| | ��������ĩ״��/mol | ���Ũ�ȼ���� | ��Ӧ�¶� | ||
| A | Mg | 0.1 | 3mol��L-1���� | 10mL | 25�� |
| B | Fe | 0.1 | 3mol��L-1���� | 10mL | 25�� |
| C | Mg | 0.1 | 3mol��L-1���� | 10mL | 25�� |
| D | Mg | 0.1 | 6mol��L-1���� | 10mL | 60�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ʵ����ʵ���������Ӧ���۲���ȷ���ǣ�
| ѡ�� | ʵ �� �� ʵ | �� �� |
| A | �����������䣬 0.01mol/L��KMnO4������Һ�ֱ���0.1mol/L��H2C2O4��Һ��0.2mol/L��H2C2O4��Һ��Ӧ��������ɫʱ��̡� | ��������������ʱ������Ӧ��Ũ�ȿ���ʹ��ѧ��Ӧ���ʼӿ� |
| B | �����������䣬�ֱ�����������ʵ���Ũ�ȵ�Na2S2O3��Һ��H2SO4���Һ������ˮ����ˮ�У�������ˮ�еĻ��Һ�ȳ��ֻ��ǡ� | ��������������ʱ����Ӧ��ϵ���¶�Խ�ߡ���ѧ��Ӧ����Խ�� |
| C | ������MnO2��ĩ����ʢ��10%˫��ˮ����ƿ�ڣ��ڻ�ѧ��Ӧǰ��MnO2�������ͻ�ѧ���ʶ�û�з����ı䡣 | ������Ȼ���Լӿ컯ѧ��Ӧ�����ʣ���һ�������뻯ѧ��Ӧ���� |
| D | һ�������£��ֱ����ݻ�Ϊ1L���ݻ�Ϊ2L�������ܱ������м�������������͵��������������·�Ӧ��H2(g)��I2(g) 2HI(g)����õ���HIʱ��Ҫ��ʱ��ǰ���١� 2HI(g)����õ���HIʱ��Ҫ��ʱ��ǰ���١� | ��������������ʱ����̬��Ӧ��ϵ��ѹǿԽ��ѧ��Ӧ����Խ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�������µĶ����ܱ������У������ʵ��������������ٱ仯ʱ�����ܱ�����Ӧ��A(s)+2B(g) C(g)+D(g)�Ѵ�ƽ����ǣ� ��
C(g)+D(g)�Ѵ�ƽ����ǣ� ��
| A����������ѹǿ | B�����������ܶ� |
| C��B�����ʵ���Ũ�� | D����������ƽ����Է������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪4NH3+5O2==4NO+6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)��ʾ������ȷ�Ĺ�ϵ�� �� ��
| A��4/5v(NH3)=v(O2�� | B��5/6v(O2)=v(H2O) | C��2/3v(NH3)=v(H2O) | D��4/5v(O2)=v(NO�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�õ������մɴ���������췢���������Ȳ������ܴ������߷���������Ч�ʡ���ҵ���û�ѧ����������Ʊ������裬�䷴Ӧ���£�
3SiCl4 (g) + 2N2 (g) + 6H2 (g)  Si3N4(s) + 12HCl (g) ?H < 0
Si3N4(s) + 12HCl (g) ?H < 0
�÷�Ӧ�ں��ݵ��ܱ������дﵽƽ��������ı�ͼ�к�����x��ֵ�����´ﵽƽ���������y��x�仯���ƺ������� �� )
| ѡ�� | x | y |
| A | �¶� | �����ڻ��������ܶ� |
| B | N2 �����ʵ��� | H2��ת���� |
| C | H2��Ũ�� | ƽ�ⳣ��K |
| D | ѹǿ | N2 ��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�Կ��淴ӦN2��g��+3H2��g�� 2NH3��g������H=��92.4 kJ��mol��1����������ȷ����
2NH3��g������H=��92.4 kJ��mol��1����������ȷ����
| A���ﵽ��ѧƽ��ʱ���������¶ȣ�������Ӧ���ʼ�С���淴Ӧ�������� |
| B������λʱ��������x mol N2��ͬʱ����2x mol NH3����Ӧ�ﵽƽ��״̬ |
| C���ﵽƽ������������СΪԭ����һ�룬���´ﵽƽ���c��NH3����Ϊԭƽ��ʱ��2�� |
| D�����ﵽƽ��ʱ�����ų�46.2kJ����������l mo1NH3��g������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com