
下列各组物质中,按单质、化合物、混合物顺序排列的是
A.金属钙、生石灰、碱石灰 B.铁、四氧化三铁、冰水混合物
C.水银、空气、干冰 D.二氧化硫、水蒸气、天然气
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源:2016届山西省高三上学期11月阶段性测试化学试卷(解析版) 题型:选择题
下列气体的干燥和吸收方法正确的是
A.氨气可以用五氧化二磷干燥
B.氮气和氢气反应合成氨气由于反应物转化率较低,用水吸收该混合气体中的氨气不用防倒吸
C.浓硫酸不能干燥硫化氢气体,应该用碱石灰
D.制得的氯气中混有杂质氯化氢气体可用饱和碳酸氢钠溶液吸收
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
配制一定体积、一定物质的量浓度的溶液,实验结果产生偏高影响的是
A.容量瓶中原有少量蒸馏水 B.溶解所用的烧杯未洗涤
C.称量时左码右物 D.定容时俯视观察液面
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市兖州区高二上学期期中测试化学试卷(解析版) 题型:选择题
气态PCl5的分解反应为2PCl5(g) 2PCl3(g)+2Cl2(g),在473K达到平衡时气态PCl5有48.5%分解,在573K达到平衡时气态PCl5有97%分解,则此反应是
2PCl3(g)+2Cl2(g),在473K达到平衡时气态PCl5有48.5%分解,在573K达到平衡时气态PCl5有97%分解,则此反应是
A.放热反应
B.吸热反应
C.反应的焓变为零的反应
D.无法判断是吸热反应还是放热反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市兖州区高一上学期期中测试化学试卷(解析版) 题型:选择题
鉴别氯化铁溶液与氢氧化铁胶体最简便的方法是
A.萃取 B.蒸馏 C.过滤 D.用激光笔照射
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一上学期期中测试化学试卷(解析版) 题型:计算题
(8分)用KMnO4氧化密度为1.19g·cm-3溶质质量分数为36.5%的HCl溶液。反应方程式如下:
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O(写出计算过程)
(1)所用HCl溶液的物质的量浓度是多少?
(2)15.8gKMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(3)若Cl2在标准状况下的密度为3.17g·L-1,则产生的Cl2 在标准状况下的体积为多少?
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上学期期中测试化学试卷(解析版) 题型:填空题
(10分)高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g) 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=________ ,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正) v(逆) (填“>” “=” “<”),反应经过2min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________ ,CO的平衡转化率=________ ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A、减少Fe的量 B、增加Fe2O3的量 C、移出部分CO2
D、提高反应温度 E、减小容器的容积 F、加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高二上学期期中测试化学试卷(解析版) 题型:填空题
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.010 mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.010 mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号);
A.v逆(A)=2v正(B) B.容器内压强保持不变
C.v(C)=2v(B) D.容器内气体的密度保持不变
(2)若在相同的容器中加入0.100 mol A和0.050molB,500℃时充分反应达平衡后,放出热量Q2kJ,则2Q1 Q2(填“>”、“<”或“=”);
(3)500℃时,上述反应的化学平衡常数K= ;
(4)已知:K(300℃)<K(350℃),该反应是 (填“放热”或“吸热”)热反应;若反应温度升高,A的转化率 (填“增大”、“减小”或“不变”);
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A) K(B)(填“>”、“<”或“=”)。
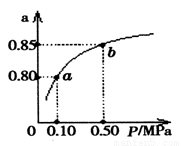
查看答案和解析>>
科目:高中化学 来源:2016届湖北省襄阳市高三上学期期中测试化学试卷(解析版) 题型:选择题
工业上常用还原沉淀法处理含铬废水(Cr2 和Cr
和Cr ),其流为:
),其流为:
Cr
 Cr2
Cr2
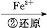 Cr3+
Cr3+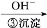 Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr (黄色)+2H+
(黄色)+2H+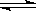 Cr2
Cr2 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) 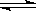 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr 浓度增大
浓度增大
B.步骤①中当2v(Cr )=v(Cr2
)=v(Cr2 )时,说明反应2Cr
)时,说明反应2Cr (黄色)+2H+
(黄色)+2H+  Cr2
Cr2 (橙色)+H2O达到平衡状态
(橙色)+H2O达到平衡状态
C.步骤②中,若要还原1 mol Cr2 ,需要12 mol (NH4)2Fe(SO4)2·6H2O
,需要12 mol (NH4)2Fe(SO4)2·6H2O
D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com