
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的平衡浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2c1>c3 | B. | a+b=92.4 | C. | 2p2>p3 | D. | α1+α3<1 |
分析 甲容器反应物投入1molN2、3molH2,乙容器反应物投入量2molNH3,恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡;
甲容器反应物投入1molN2、3molH2,丙容器反应物投入量4molNH3,采用极限转化法转化为反应物为2molN2、6molH2,是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡;据此分析平衡移动.
解答 解:甲投入1molN2、3molH2,乙容器投入量2molNH3,恒温恒容条件下,甲容器与乙容器是等效平衡,各组分的物质的量、含量、转化率等完全相等;
而甲容器投入1molN2、3molH2,丙容器加入4molNH3,采用极限转化法丙相当于加入2molN2、6molH2,丙中加入量是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器为等效平衡,所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡,由于该反应是体积减小的反应,缩小容器体积,增大了压强,平衡向着正向移动,所以丙中氮气、氢气转化率大于甲和乙的,
A、丙容器反应物投入量4molNH3,采用极限转化法转化为反应物为2molN2、6molH2,是甲中的二倍,若平衡不移动,c3=2c1;丙相当于增大压强,平衡向着正向移动,所以丙中氨气的浓度大于乙中氨气浓度的二倍,即c3>2c1,故A错误;
B、甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,故a+b=92.4,故B正确;
C、丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,丙中压强为乙的二倍;由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3,故C正确;
D、丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,转化率α1+α3=1;由于丙中相当于增大压强,平衡向着向着正向移动,氨气的转化率减小,所以转化率α1+α3<1,故D正确;
故选A.
点评 本题考查化学平衡影响因素、等效平衡、化学平衡的计算,题目计算量较大,题目难度较大,关键是构建平衡建立的等效途径,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.


科目:高中化学 来源: 题型:解答题
| Y | Z | ||
| R |
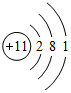 ;R在周期表中的位置为第三周期ⅢA族.
;R在周期表中的位置为第三周期ⅢA族.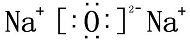 ,Q2Z2含的化学键类型为:离子键、共价键.
,Q2Z2含的化学键类型为:离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
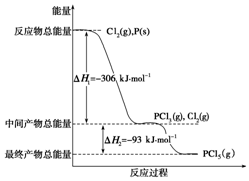 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-C | C-H | H-H | C-O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 463 |
| A. | 1550+43.2kJ•mol-1 | B. | 750-43.2kJ•mol-1 | ||
| C. | 1550+86.4kJ•mol-1 | D. | 750+43.2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S Cl 的原子半径依次减小 | |
| B. | Na Mg 的失电子能力依次增强 | |
| C. | O F的气态氢化物的稳定性依次增强 | |
| D. | Si P 的最高价含氧酸的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
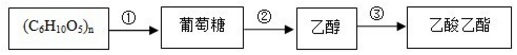
| A. | 反应②的反应类型属于分解反应 | |
| B. | (C6H10O5)n可以是淀粉或纤维素,二者互为同分异构体 | |
| C. | 将烧黑的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D与E可形成既含极性键又含非极性键的分子 | |
| B. | B的最高价氧化物为酸性氧化物,不能与任何酸反应 | |
| C. | B、C、E三种元素的最高价氧化物对应的水化物中,B的酸性最弱 | |
| D. | A、C、D中两种或三种元素形成的钠盐溶液可显酸性、中性或碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com