
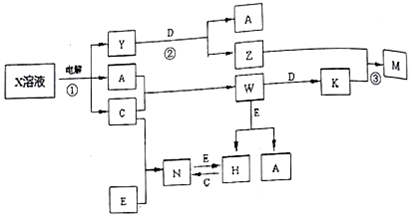
分析 反应①是工业制备C的工作方法,则应为电解饱和食盐水的反应,则X为饱和NaCl溶液,A、C是中学化学常见单质,所以Y为NaOH,A为H2,C为Cl2,W为HCl,能与NaOH反应生成H2的金属为Al,则D为Al,Z为NaAlO2,K为AlCl3,M为Al(OH)3,由转化关系可知E应为变价金属,应为Fe,则N为FeCl3,H为FeCl2,结合物质的性质以及题目的要求解答该题;
(3)漂白粉中的ClO-具有氧化性,I-具有还原性,在酸性溶液中发生氧化还原反应,生成I2、Cl-和水,再根据得失电子守恒、原子守恒配平;加入过量的KI溶液和过量的硫酸与漂白粉溶液反应发生2H++2I-+ClO-=I2+Cl-+H2O,由2Na2S2O3+I2=Na2S4O6+2NaI,得关系式Ca(ClO)2~2Cl2~2I2~4Na2S2O3,据此定量关系计算,注意溶液体积的变化.
解答 解:(1)由以上分析可知Z为NaAlO2,阳离子的电子式为Na+,E应为变价金属,应为Fe,在周期表中位于第四周期第Ⅷ族,故答案为:Na+;四;Ⅷ;
(2)反应①为电解饱和食盐水的反应,离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
反应②的离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,
反应③为AlCl3和NaAlO2的互促水解反应,反应的离子方程式为Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;2Al+2H2O+2OH-═2AlO2-+3H2↑;Al3++3AlO2-+6H2O═4Al(OH)3↓;
(3)漂白粉中的ClO-具有氧化性,I-具有还原性,在酸性溶液中发生氧化还原反应,生成I2、Cl-和水,再根据得失电子守恒、原子守恒配平,反应的离子方程式为:2H++2I-+ClO-=I2+Cl-+H2O;加入过量的KI溶液和过量的硫酸与漂白粉溶液反应发生2H++2I-+ClO-=I2+Cl-+H2O,由2Na2S2O3+I2=Na2S4O6+2NaI,得关系式Ca(ClO)2~2Cl2~2I2~4Na2S2O3,
n[Ca(ClO)2]=$\frac{1}{4}$n(Na2S2O3)=20.0mL×10-3 L•mL-1×0.1mol•L-1×$\frac{1}{4}$=0.0005mol,则该漂白粉中有效成分的质量分数=$\frac{0.0005×143}{1×1.17}$×100%=6.11%,
故答案为:2H++2I-+ClO-=I2+Cl-+H2O;6.11%.
点评 本题考查无机物的推断,题目难度中等,根据物质的典型性质,明确物质的种类为解答该题的关键,注意工业电解饱和食盐水的重要应用.


科目:高中化学 来源: 题型:选择题
| A. | 1L0.5mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA | |
| B. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| C. | 室温下,1L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| D. | ag某气体含分子数为b,c g该气体在标况下的体积为$\frac{22.4ab}{c{N}_{A}}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8gH2O与CH2D2的混合物中所含质子数为NA | |
| B. | 1mol甲烷或白磷(P4)分子中所含共价键数均为4NA | |
| C. | 1mol CH3COOC2H5在稀硫酸溶液中水解可得到乙醇分子数为NA | |
| D. | 25℃时,l L pH=1的H2SO4溶液中含有的H+ 数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 咖啡中的咖啡酸具有抗氧化、抗炎、抗粥样硬化等多种有益作用.其球棍模型如图所示,关于咖啡酸的下列说法正确的是( )
咖啡中的咖啡酸具有抗氧化、抗炎、抗粥样硬化等多种有益作用.其球棍模型如图所示,关于咖啡酸的下列说法正确的是( )| A. | 分子式为C9H10O4 | |
| B. | 分子中至少有9个碳原子共平面 | |
| C. | 1 mol咖啡酸与足量NaHCO3反应生1 mol CO2 | |
| D. | 1 mol咖啡酸最多能够与5 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1mol•L-1HF溶液中pH=1 | |
| B. | 向AgI饱和溶液中加入NaCl溶液,不会有AgCl沉淀析出 | |
| C. | 25℃时,使AgCl转化为AgI,则加入KI溶液的浓度不低于5×10-12mol/L | |
| D. | 向1L 0.1mol/LHF溶液中加入1L 0.1mol/LCaCl2溶液,没有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}、点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | H2SO4(稀)$\stackrel{Cu}{→}$SO2$\stackrel{BaCl_{2}}{→}$BaSO4 | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(ap)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | SiO2$\stackrel{NaOH}{→}$NaSiO3$\stackrel{HCl}{→}$H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煅烧粉碎的硫铁矿有利于SO2生成 | |
| B. | 由H2、I2、HI三种气体组成的平衡体系加压后颜色变深 | |
| C. | 使用铁触媒,有利于N2和H2的混合气体合成NH3 | |
| D. | 实验室常用排饱和和食盐水法收集Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
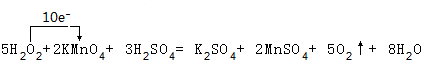 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO4-、SO42- | B. | K+、Cl-、Ba2+、HCO3- | ||
| C. | K+、Na+、Cl-、Br- | D. | Na+、CO32-、A1O2-、C1- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com