
【题目】A、B、C、D是位于短周期的主族元素。已知:①热稳定性:HmD>HmC; ②Cm+、E(m+1)+具有相同的电子层结构;③A与B在同一周期,在该元素所有主族中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子的3倍。
依据上述信息用相应的化学用语回答下列问题:
(1)B元素在周期表的位置_____________;
(2)HmDm的电子式______________;
(3)Cm-的结构示意图______________;
(4)AmDm的化学键类型_________;
(5)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为_________;
(6)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式____________________。
【答案】(1)第三周期IIIA族;
(2)![]()
(3)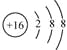
(4)离子键和共价键(或极性键)
(5) Cl2+2OH-=Cl-+ClO-+H2O;
(6)H2S+OH-=HS-+H2O
【解析】试题分析:在短周期所有主族元素中A的原子半径最大,则A为Na元素;A与B在同一周期,在该周期所有主族元素中,B的离子半径最小,则B为Al元素;A与B质子数之和是D质子数的3倍,D的质子数为:![]() ×(13+11)=8,则D为O元素;热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为S元素,m=2;Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素。
×(13+11)=8,则D为O元素;热稳定性:HmD>HmC,则C、D处于同一主族,且D的非金属性更强,故C为S元素,m=2;Cm-、E(m-1)-具有相同的电子层结构,则E为Cl元素。
(1)B为Al元素,位于周期表的第三周期III族,故答案为:第三周期IIIA族;
(2)HmDm为H2O2,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)Cm-为S2-,结构示意图为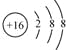 ,故答案为:
,故答案为: ;
;
(4)AmDm为Na2O2,过氧化钠为离子化合物,其电子式为:![]() ,含有离子键和共价键,故答案为:离子键和共价键;
,含有离子键和共价键,故答案为:离子键和共价键;
(5)E的单质为氯气,A与D形成的化合物的水溶液为NaOH溶液,在常温下氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(6)常温下,将等物质的量浓度的H2S溶液和NaOH溶液等体积混合,该反应的离子方程式为H2S+OH-=HS-+H2O,故答案为:H2S+OH-=HS-+H2O;


 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】(1)有以下八种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(ClO)2;④CaCl2;⑤Na2CO3;⑥NaAlO2;⑦NH3和NaCl;⑧Na2SiO3。向其中分别持续通入CO2,最终能得到沉淀或析出晶体的__ 。
(2)根据下列描述写出下列化学方程式:
①已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的离子方程式: 。
② 联氨(N2H4)是航天飞船常用的高能燃料。联氨可以采用尿素CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素【CO(NH2)2】和次氯酸钠、氢氧化钠溶液反应生成联氨、碳酸钠、另一种钠盐和水,写出其反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成,现利用如图所示流程,以环己烯为原料合成环醚、聚酯和合成橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。
已知:R1HC=CHR2→R1-CHO+R2-CHO
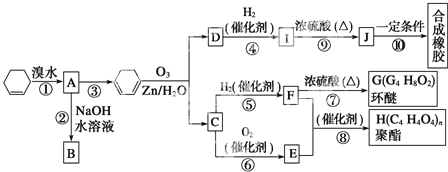
(1)③的反应条件是_______________________。
(2)H的名称是_________________________。
(3)有机物B和I的关系为_____(填序号)。
A.同系物 B.同分异构体 C.都属于醇类 D.都属于烃
(4)写出反应⑩的化学方程式:________________。
(5)写出两种D的属于酯类的链状同分异构体的结构简式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2S和H2Se的参数对比见右表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3° | -60.75 |
H2Se | 1.47 | 91.0° | -41.50 |
①H2Se的晶体类型为__________________;
②H2S的键角大于H2Se的原因可能__________________;
分子晶体
;;
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为___;(用元素符号表示)
(3)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为____________1:3
;若该晶体的晶胞参数为a pm,则该合金密度
为_______________g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
(4)Fe(CO)5与NH3在一定条件下可合成一种具有磁性的氮化铁。
①1molFe(CO)5分子中含有σ键的数目为____________1:3
;
②该磁性氮化铁晶胞结构如图所示,该化合物的化学式____________。1:3
。。。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示,由图中数据分析:

(1)该反应的化学方程式 。
(2)反应开始至2min,以Z表示的平均反应速率为 。
(3)反应达平衡此时体系的压强是开始时 倍。
(4)下列叙述能说明上述反应达到化学平衡状态的是 (填字母)
A.混合气体的总物质的量不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成2mol Z
C.混合气体的密度不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于卤素(用X表示)的叙述正确的是( )
A. 其单质都能与水反应,通式为X2+H2O===HX+HXO
B. HX易溶于水,其水溶液都是强酸
C. 其单质都有颜色,都有毒
D. 最高价含氧酸的通式为HXO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
【提出假设】假设1:气体产物只有SO2; 假设2:_____________;
【实验设计】为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应.

(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后_____________,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象.反应后硫酸盐中金属显+2价.写A中发生反应的化学方程式_____________;
(3)若假设2正确,则可观察到:F管中_____________;G干燥管里_____________;
【实验反思】为了进一步探究金属M成分和气体组分,进行如下实验:
称取11.2g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液.稀释烧瓶里溶液的操作方法_______;
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去;所以可得到此条件下对金属M与浓硫酸反应的气体产物的探究假设 ________成立。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知某粒子的结构示意图为: 。试回答:
。试回答:
①当x-y=10时,该粒子为________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,阳离子可能为(填离子符号)________、________。
(2)原子序数大于4的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,据此推断:元素A 和B所属周期序数之差为________;元素A和B的原子序数之差为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com