
| A. | 溶解度:MgCO3>Mg(OH)2 | B. | 金属性:Mg<K | ||
| C. | 还原性:H2S<SiH4 | D. | 稳定性:HF>PH3 |
分析 元素周期律内容包括金属性、非金属性、氢化物稳定性等方面,但是溶解度属于物理性质,不能用元素周期律解释.
解答 解:A.溶解度MgCO3>Mg(OH)2,属于碳酸镁和氢氧化镁的物理性质,不能用元素周期律解释,故A正确;
B.同一主族元素,原子序数越大,金属性越强,同一周期中,原子序数越大,金属性越弱,金属性Mg<K可用元素周期律解释,故B错误;
C.非金属性越强,氢化物还原性越弱,则还原性H2S<SiH4能够用元素周期律解释,故C错误;
D.非金属性越强,氢化物稳定性越强,稳定性HF>PH3可以用元素周期律解释,故D错误;
故选A.
点评 本题考查了元素周期表的结构及其应用,题目难度不大,明确元素周期律内容为解答关键,注意掌握判断金属性、非金属性强弱的方法,试题侧重考查学生的灵活应用能力.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中氯化钠的浓度为1 mol/L | |
| B. | 向所得的溶液中通入二氧化碳,可使溶液具备漂白性 | |
| C. | 所得溶液中有大量的单质的氯元素存在 | |
| D. | 在反应中氯元素化合价降低,钠元素化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,用NaOH溶液滴定20.00mL0.1mol•L-1CH3COOH溶液所得滴定曲线如图,下列说法正确的是( )
常温下,用NaOH溶液滴定20.00mL0.1mol•L-1CH3COOH溶液所得滴定曲线如图,下列说法正确的是( )| A. | 点①所示溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) | |
| B. | 点②所示溶液中:c(Na+)═c(CH3COOH)+c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
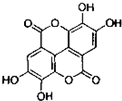 ).
).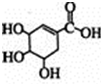 +Br2→
+Br2→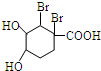 .
.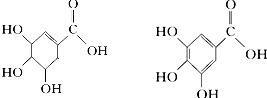
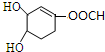 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用PH试纸测得某浓度的Na2CO3溶液的PH值为10.2 | |
| B. | 已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,在定量测定该反应速率时,可用排水法测SO2的体积,计算反应速率 | |
| C. | 蒸发结晶时,将蒸发皿中的溶液蒸干后得到所需固体 | |
| D. | 脂皂化反应后的反应液中加入饱和食盐水并搅拌后,生成的高级脂肪酸钠浮在水面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
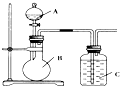 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知砷(As)元素的原子结构示意图为:
已知砷(As)元素的原子结构示意图为:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精灯的使用,酒精灯熄灭时不能用嘴吹灭 | |
| B. | 温度计的使用,温度计不仅可以测量温度,还可以用于物质溶解时的搅拌 | |
| C. | 托盘天平的使用,潮湿的或具有腐蚀性的药品,必须放在玻璃器皿里称量,其他固体药品可直接放在天平托盘上称量 | |
| D. | 试管的加热,手持试管给固体或液体加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com