

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
(7分)把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) === CO2(g)
途径II:先制水煤气: C(s)+ H2O(g) === CO(g) + H2(g)
燃烧水煤气:2 CO(g) + O2(g) === 2CO2(g); 2H2(g)+O2(g)===2H2O(g)
已知:①C(s)+O2(g)===CO2(g);△H1=-393.5 kJ·mol-1
②H2(g)+O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+ O2(g) =CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)C(煤)的标准燃烧热是
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量
(4)根据两种途径,下列说法错误的是 (单选)
A.途径II制水煤气时增加能耗,故途径II的做法不可取
B.与途径I相比,途径II可以减少对环境的污染
C.与途径I相比,途径II可以提高煤的燃烧效率
D.将煤转化为水煤气后,便于通过管道进行运输
查看答案和解析>>
科目:高中化学 来源: 题型:
TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答: (填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答: 。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s)+2Cl2 (g)TiCl4(l)+O2(g) ΔH=+151 kJ·mol-1
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s)+O2 (g) =CO2 (g) ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C(s)+2Cl2 (g) = TiCl4 (l)+CO2(g) ΔH= ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三毕业班教学质量检查理综化学试卷(解析版) 题型:填空题
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:

(1)写出X的原子结构示意图_______________。
(2)列举一个事实说明W非金属性强于Z: _______________(用化学方程式表示)。
(3)含Y的某种盐常用作净水剂,其净水原理是__________(用离子方程式表示)。
II.运用所学化学原理,解决下列问题:
(4)已知:Si+2NaOH+H2O=Na2SiO3+2H2。某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为_________________。
(5)已知:①C(s)+ O2(g)=CO2(g)?  H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)
H=a kJ· mol-1;②CO2(g) +C(s)=2CO(g)  H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?
H=b kJ· mol-1;③Si(s)+ O2(g)=SiO2(s)?  H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
H=c kJ· mol-1。工业上生产粗硅的热化学方程式为____________。
(6)已知:CO(g)+H2O(g) H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的
H2(g) + CO2(g)。右表为该反应在不同温度时的平衡常数。则:该反应的 H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。
H________0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为_________。

查看答案和解析>>
科目:高中化学 来源:2013届福建泉州晋江市高二下学期期中化学试卷(解析版) 题型:填空题
(7分)把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) === CO2(g)
途径II:先制水煤气: C(s) + H2O(g) === CO(g) + H2(g)
燃烧水煤气:2 CO(g) + O2(g) === 2CO2(g); 2H2(g)+O2(g) ===2H2O(g)
已知:①C(s)+O2(g)===CO2(g);△H1=-393.5 kJ·mol-1
②H2(g)+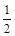 O2(g)=H2O(g);△H2=-241.8kJ·mol-1
O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+ 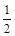 O2
(g) =CO2(g);△H3=-283.0kJ·mol-1
O2
(g) =CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)C(煤)的标准燃烧热是
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量
(4)根据两种途径,下列说法错误的是 (单选)
A.途径II制水煤气时增加能耗,故途径II的做法不可取
B.与途径I相比,途径II可以减少对环境的污染
C.与途径I相比,途径II可以提高煤的燃烧效率
D.将煤转化为水煤气后,便于通过管道进行运输
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com