
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| c(C)?c(D) |
| c(A)?c(B) |
| c(C)?c(D) |
| c(A)?c(B) |
| 0.2mol |
| 5L |
| x×x |
| (0.04-x)×(0.16-x) |
| 0.032mol/L |
| 0.04mol/L |
| 0.1+0.2 |
| 0.8+x+0.1 |
| 0.2 |
| 0.8 |
| 1 |
| 0.4 |


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
| A、该溶液中的溶质不可能是NaHSO4 | ||
| B、向该溶液中加入铝粉,一定能产生大量H2 | ||
C、下列离子在该溶液中一定能大量共存:Ca2+、Cl-、K+、NO
| ||
| D、向该溶液中加入NaHCO3,一定有化学反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
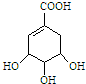 (1)按系统命名法命名.有机物CH3CH(C2H5)CH(CH3)2的名称是
(1)按系统命名法命名.有机物CH3CH(C2H5)CH(CH3)2的名称是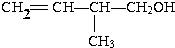
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应 可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应 |
B、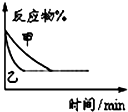 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 |
C、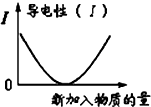 可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
D、 表示10mL 0.01 mol?L-1 KMnO4酸性溶液与过量的0.1mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 表示10mL 0.01 mol?L-1 KMnO4酸性溶液与过量的0.1mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com