



科目:高中化学 来源: 题型:
| 选项 | 具体做法 | 相关原理 |
| A | 将食物储存在冰箱里 | 温度降低,反应速率减小 |
| B | 医院透视用硫酸钡作“钡餐” | 硫酸钡既不溶于水也不溶于酸 |
| C | 实验室制备氢气用粗锌代替纯锌 | 形成微型原电池,加快反应速率 |
| D | 医疗上血液透析 | 利用了胶体的丁达尔效应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
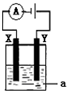 Ⅰ.(1)事实证明,原电池中发生的反应通常是放热反应.利用下列化学反应可以设计成原电池的是
Ⅰ.(1)事实证明,原电池中发生的反应通常是放热反应.利用下列化学反应可以设计成原电池的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com