
| A. | 铝与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | NaOH与HCl的反应 |
分析 属于氧化还原反应说明该反应中有电子转移,其特征是有元素化合价升降,属于放热反应说明该反应中反应物总能量大于生成物总能量,据此分析解答.
解答 解:A.金属与酸的反应属于放热反应,且属于置换反应,是氧化还原反应,故A正确;
B.Ba(OH)2•8H2O与NH4Cl 的反应属于吸热反应,且该反应中没有元素化合价变化,不属于氧化还原反应,故B错误;
C.C+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO,该反应是吸热反应,故C错误;
D.酸碱中和反应属于放热反应,也是复分解反应,不是氧化还原反应,故D错误,
故选A.
点评 本题考查了氧化还原反应、放热反应的判断,根据元素化合价是否变化确定是否是氧化还原反应,再结合反应热分析解答,常见的放热反应有:中和反应、所有的燃烧反应、大多数化合反应等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
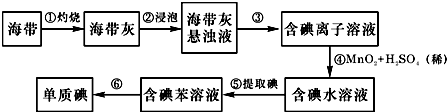
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
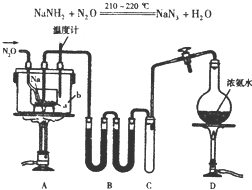 NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:
NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-) | B. | n(NH4+) | C. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | D. | n(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com