
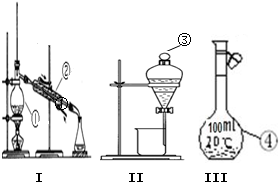
 (1)写出下图中序号①~③仪器的名称:
(1)写出下图中序号①~③仪器的名称: 请回答下列问题:
请回答下列问题:| 1000ρw |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |
| 1mol/L×0.5L |
| 18.4mol/L |


科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
周期 族 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑾ | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22.4L CH4中含有的C-H键数为4NA |
| B、4.6g由NO2和N2O4组成的混合气体中含有的氧原子数为0.3NA |
| C、含0.2mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA |
| D、1mol Na在足量O2中燃烧生成Na2O2,钠失去的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学按图所示的装置实验,并把实验情况记录于下,其中叙述合理的是( )
某同学按图所示的装置实验,并把实验情况记录于下,其中叙述合理的是( )| A、①②③ | B、③④⑥ |
| C、③④⑤ | D、②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com