
【题目】向2 L的密闭容器中充入1mol A和1mol B,反应 A(g) + B(g)C(g) + D(g) ΔH的平衡常数(K)和温度(T)的关系如下:
温度/ ℃ | 700 | 800 | 900 |
平衡常数 | 0.1 | X | 1 |
800℃时,经5s反应达到平衡状态,此时B的平均反应速率v(B)=0.04 mol/(L·s)。下列说法不正确的是
A.平衡时,c(B)为0.6 mol·L-1
B.800℃时平衡常数X=4/9
C.ΔH >0
D.900℃该反应达到平衡状态时,A的物质的量为0.5 mol
科目:高中化学 来源: 题型:
【题目】已知H3PO4是一种三元中强酸。25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示。下列说法正确的是
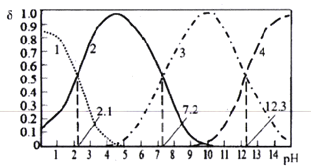
A. 曲线2和曲线4分别表示δ(HPO42-)和δ(PO43-)变化
B. 25℃时,H3PO4的电离常数K1:K2=105.1
C. pH=7.2时,溶液中由水电离出的c(H+)=10-7.2mol/L
D. pH=12.3时,溶液中2c(Na+)=5c(H2PO4-)+5c(HPO42-)+5c(PO43-)+5c(H3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

其中平衡(Ⅰ)隔板在2.8处,平衡(Ⅱ)隔板在2.6处。
下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达平衡(Ⅰ)时,X的转化率为5/6
C.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
D.对于反应②,平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为10 :11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出了14种元素的电负性:

运用元素周期律知识完成下列各题。
(1)同一周期中,从左到右,主族元素的电负性________;同一主族中,从上到下,元素的电负性________。所以主族元素的电负性随原子序数递增呈____________变化。
(2)短周期元素中,电负性最大的元素与氢元素形成的化合物属于________化合物,用电子式表示该化合物的形成过程__________________________。
(3)已知:两成键元素间的电负性差值大于1.7时,通常形成离子键,两成键元素间的电负性差值小于1.7时,通常形成共价键。则Mg3N2、BeCl2、AlCl3、SiC中为离子化合物的是________,为共价化合物的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池,将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是( )
2Na2CO3+C。下列说法错误的是( )
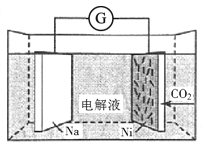
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-=2CO32-+C
D.充电时,阳极反应为Na++e-=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )

A.Ka(HA)=1×10-6mol/L
B.b点c(B+)=c(A-)=c(OH-)=c(H+)
C.c点时,![]() 随温度升高而减小
随温度升高而减小
D.a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与2mol Y (g),下列说法正确的是( )
A.充分反应后,X的转化率和Y的转化率不相等,前者大于后者
B.当反应达到平衡状态时,W与M的物质的量浓度之比一定为2:1
C.当混合气体的密度不再改变,表明该反应已达平衡
D.若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示。请回答:
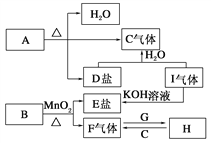
(1)画出G离子结构示意图________;
(2)写出B、I的化学式B________,I________;
(3)写出H的一种用途__________________________________;
(4)写出A受热分解的化学方程式_________________________;
(5)若10g的C6H12O6在氧气中充分燃烧,将产物全部与足量的H充分反应,反应后固体增重____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问題。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;水的电离程度将________(填“增大”、“减小”或“不变”)。
(2)99℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为__________。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是________(填字母)。
a.![]() 、
、![]() b.
b.![]() 、
、![]() c.
c.![]() 、
、![]() d.H2SO3、
d.H2SO3、![]()
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是_______。
(4)0.1 mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中 c(H2A)________c(A2-)(填“>”、“<”或“=”),作出此判断的依据是__________(用文字解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com