

| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
分析 (1)浓硫酸随反应进行浓度变小后,稀硫酸和锌反应生成氢气,所以气体杂质含有氢气;锌和浓硫酸反应生成硫酸锌,二氧化硫和水,锌和稀硫酸反应生成硫酸锌和氢气,据此书写化学方程式;
(2)硫酸完全反应,发生反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,Zn+H2SO4=ZnSO4+H2↑,结合方程式计算;
(3)证明气体中含有氢气,酸性高锰酸钾溶液目的吸收生成的二氧化硫气体,则B装置中加浓硫酸吸收气体表面的水分,装置C将残留的气体通过灼热的氧化铜反应,目的是验证该气体具有还原性,装置D无水硫酸铜检验水,若变蓝色则C装置反应生成水,根据元素守恒且该气体具有还原性,则X气体为H2,据此进行分析;
(4)A.氨气密度比空气小;
B.澄清石灰水浓度较小;
C.铁与稀硝酸反应产生的气体为NO,一氧化氮难溶于水;
D.浓盐酸和高锰酸钾反应生成氯气.
解答 解:(1)浓硫酸随反应进行浓度变小后,稀硫酸和锌反应生成氢气,所以气体杂质含有氢气;锌和浓硫酸反应生成硫酸锌,二氧化硫和水,故对应的化学方程式为Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4 +SO2↑+2H2O,锌和稀硫酸反应生成硫酸锌和氢气,
故对应的化学方程式为Zn+2H2SO4=ZnSO4 +H2↑,
故答案为:H2;Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4 +SO2↑+2H2O、Zn+2H2SO4=ZnSO4 +H2↑;
(2)一定质量的Zn与87.5mL 16.0mol/L的H2SO4的浓溶液充分反应,反应后称量剩余锌发现质量减少了78.0g,则参加反应Zn的物质的量为1.2mol,H2SO4的物质的量为0.0875L×16mol/L=1.4mol,
由于硫酸都没有剩余,设与浓硫酸反应的Zn为xmol,与稀硫酸反应的Zn为ymol,则:
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x x
Zn+H2SO4=ZnSO4+H2↑
y y y
由题意可知:
$\left\{\begin{array}{l}{x+y=1.2}\\{2x+y=1.4}\end{array}\right.$,解得x=0.2,y=1.0,
产生SO2体积(标准状况下)=0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
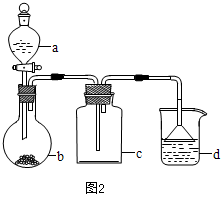
(3)证明气体中含有氢气,酸性高锰酸钾溶液目的吸收生成的二氧化硫气体,则B装置中加浓硫酸吸收气体表面的水分,装置C将残留的气体通过灼热的氧化铜反应,目的是验证该气体具有还原性,装置D无水硫酸铜检验水,若变蓝色则C装置反应生成水,根据元素守恒且该气体具有还原性,则X气体为H2,
①由以上分析得,酸性KMnO4溶液的作用是除去二氧化硫气体;B中添加的试剂是浓硫酸,
故答案为:除去二氧化硫气体;浓硫酸;
②由以上分析得,装置C中所装药品为CuO;可证实气体X中混有较多量某杂质气体的实验现象是C中黑色粉末变为红色,D中的白色固体变为蓝色,
故答案为:CuO;C中黑色粉末变为红色,D中的白色固体变为蓝色;
(4)A.氨气密度比空气小,集气瓶中导管应短进长出,故A错误;
B.澄清石灰水浓度较小,不能用来处理尾气,故B错误;
C.铁与稀硝酸反应产生的气体为NO,一氧化氮难溶于水,不能用溶液吸收,故C错误;
D.浓盐酸和高锰酸钾反应生成氯气,氯气可用氢氧化钠吸收,故D正确;
故答案为:D.
点评 本题考查了制备方案设计,题目难度中等,侧重于考查学生的实验探究能力,注意把握硫酸及其化合物的性质,明确实验目的和实验原理是解题的关键.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ②③④ | C. | ②④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该粉末中可能是Fe2(SO4)3和Al(NO3)3的混合物 | |
| B. | 沉淀乙和丙都是BaSO4 | |
| C. | 气体乙和丙分别是NH3和H2 | |
| D. | 气体甲可能由A13+与CO32-相互促进水解得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量 | |
| B. | 寻找优质催化剂,在常温常压下使CO2分解生成碳与O2 | |
| C. | 寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2) | |
| D. | 将固态碳合成为C60,以C60作为燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲中,为检查装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原 | |
| B. | 图已中,可以比较KMnO4、Cl2和S氧化性的相对强弱 | |
| C. | 将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升 | |
| D. | 图丁中,可用装置验证NaHCO3和Na2CO3的热稳定性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色透明的酸性溶液:Cl-、Na+、MnO4-、SO42- | |
| B. | 含CO32-的溶液:K+、Na+、AlO2-、Cl- | |
| C. | 能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32- | |
| D. | 由水电离产生的c(H+)=10-12mol/L的溶液:K+、I-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①:制取乙炔并验证炔烃的性质 | |
| B. | 装置②:检验乙醇的还原性,溶液颜色从紫红色色变无色 | |
| C. | 装置③:产生银镜,说明蔗糖分子中含有醛基官能团 | |
| D. | 装置④:酸性KMnO4溶液中出现气泡且逐渐褪色,说明有不同于烷烃的另一类烃产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯甲醇 | B. | 环己醇 | C. | 1-己醇 | D. | 间甲基苯甲醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com