
(8分)下图是氨氧燃料电池示意图,按照此图的提示,回答下列问题:
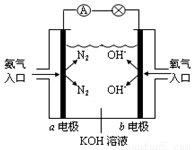
(1)a电极作______极(填“正”、“负”或“阴”、“阳”),其电极反应式为_________________;
(2)反应一段时间后,电解质溶液的PH将 (填“增大”、“减小”或“不变”);
(3)已知N2(g)+3H2(g)=2NH3(g) ΔH= —92.4 kJ·mol-1 ;2H2(g)+O2(g)=2H2O(g) ΔH= —483.6 kJ·mol-1,试写出氨气完全燃烧生成气态水的热化学方程式:__________________________;
(4)若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上97.5g锌,理论上至少需要消耗氨气_________L(标准状况)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
(16分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)该产业链中合成氨的反应在较低温下能否自发进行? 。
(2)已知该产业链中某反应的平衡表达式为:
它所对应的化学反应为: 。
(3)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g) 2CO(g),K1
CO(g)+H2O(g H2(g)+CO2(g), K2
C(s)+H2O(g) CO(g)+H2(g) ,K3
则K1、K2、K3之间的关系是: 。
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: 。
(5)从图中看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是和
。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。
对反应N2O4(g)2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式 。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
(16分)肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水。氢气是一种清洁能源,液氢和肼均可用作火箭燃料。
Ⅰ 氢气的制取与储存是氢能源利用领域的研究热点。
已知: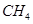 (g)+
(g)+ 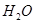 (g)=
(g)=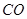 (g)+
(g)+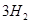 (g)
(g) 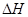 =
+
=
+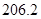

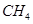 (g)+
(g)+ 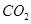 (g)=
(g)=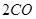 (g)+
(g)+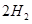 (g)
(g)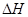 = +
= +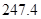

(1)氢气作为新能源的优点 。(答2点)
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。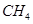 (g)与
(g)与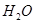 (g)反应生成
(g)反应生成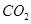 (g)和
(g)和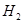 (g)的热化学方程式为
。
(g)的热化学方程式为
。
(3)H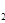 O的热分解也可得到H
O的热分解也可得到H ,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是
、 。
,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是
、 。
Ⅱ(4)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,负极的电极反应式是 。
(5)下图是一个电化学装置示意图。用肼一空气燃料电池做此装置的电源。
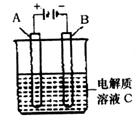
①如果A是铂电极,B是石墨电极,C是硫酸—硫酸铵,阴极的电极反应式是 。
②利用该装置可制得少量过氧化氢:在阳极上SO42—被氧化成S2O82—(过二硫酸根离子),S2O82—与H2O反应生成H2O2,S2O82—+2H2O=2SO42—+H2O2+2H+。若要制取2molH2O2,该燃料电池理论上需消耗 molN2H4。
(6)由A、B、C、D四种金属按下表中装置进行实验。
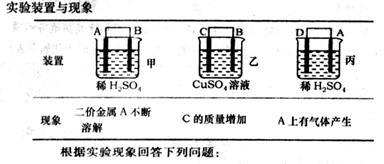
①装置丙中溶液的P H 。(填“变大”“变小”或“不变”)
②四种金属活泼性由弱到强的顺序是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省温州市十校联合体高三上学期期中联考化学试卷 题型:填空题
(16分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)该产业链中合成氨的反应在较低温下能否自发进行? 。
(2)已知该产业链中某反应的平衡表达式为:
它所对应的化学反应为: 。
(3)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g)  2CO(g),K1
2CO(g),K1
CO(g)+H2O(g  H2(g)+CO2(g), K2
H2(g)+CO2(g), K2
C(s)+H2O(g) CO(g)+H2(g) ,K3
CO(g)+H2(g) ,K3
则K1、K2、K3之间的关系是: 。
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: 。
(5)从图中看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为
。
。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为
。
对反应N2O4(g)
 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。

下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式 。
查看答案和解析>>
科目:高中化学 来源:浙江省期中题 题型:填空题

 反应生成
反应生成 的热化学方程式为___________________ 。
的热化学方程式为___________________ 。


查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题


 2CO2(g)+N2(g) 在某温度T1℃下,2L密闭容器中充入NO 、CO各0.4mol,测得不同时间的NO和CO物质的量如下表:
2CO2(g)+N2(g) 在某温度T1℃下,2L密闭容器中充入NO 、CO各0.4mol,测得不同时间的NO和CO物质的量如下表: 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com