
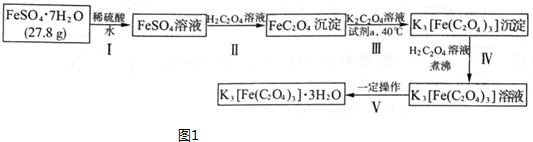
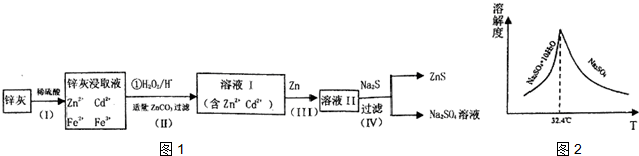
分析 制备K3[Fe(C2O4)3]•3H2O的流程:硫酸亚铁加入稀硫酸抑制Fe2+水解,硫酸亚铁与草酸反应生成草酸亚铁沉淀,用过氧化氢将草酸亚铁氧化为K3[Fe(C2O4)3],加入草酸溶液煮沸后,一定条件下结晶得到K3[Fe(C2O4)3]•3H2O晶体.
(1)亚铁离子在水溶液中水解,加入稀硫酸抑制水解;步骤Ⅱ中发生(NH4)2Fe(SO4)2•6H2O+H2C2O4═FeC2O4↓+(NH4)2SO4+H2SO4+6H2O,本质为亚铁离子和草酸生成草酸亚铁的沉淀,根据其离子反应方程式结合Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=5.4×10-5、Ksp(FeC2O4)=2.1×10-7]书写该反应的平衡常数;
(2)双氧水为绿色氧化剂,反应后煮沸即可过量的双氧水;
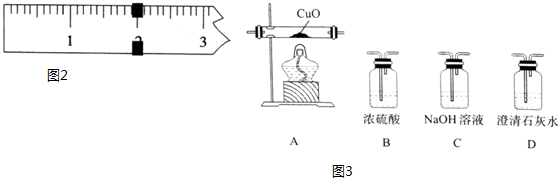
(3)被测物体的质量等于砝码的总质量与游码所对刻度之和.根据铁原子守恒计算出理论K3[Fe(C2O4)3]•3H2O质量,产率=$\frac{实际产量}{理论产量}$×100%;
(4)先用澄清石灰水检验二氧化碳,多余的二氧化碳用NaOH溶液吸收,再用澄清石灰水检验是否吸收完全,然后干燥,剩余的气体通过灼热的CuO,最后用澄清石灰水检验生成的产物.
解答 解:(1)步骤Ⅰ中:亚铁离子在水溶液中水解:Fe2++2H2O?Fe(OH)2+2H+,溶解的过程中要加入几滴稀硫酸,目的是抑制Fe2+水解,步骤Ⅱ中发生(NH4)2Fe(SO4)2•6H2O+H2C2O4═FeC2O4↓+(NH4)2SO4+H2SO4+6H2O,本质为亚铁离子和草酸生成草酸亚铁的沉淀,所以离子反应为:Fe2++H2C2O4?FeC2O4↓+2H+,化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,该反应的平衡常数K=$\frac{{c}^{2}({H}^{+})}{c(F{e}^{2+})×c({H}_{2}{C}_{2}{O}_{4})}$=$\frac{{K}_{a1}×{K}_{a2}}{{K}_{sp}}$=$\frac{5.6×1{0}^{-2}×5.4×1{0}^{-5}}{2.1×1{0}^{-7}}$=14.4;
故答案为:抑制Fe2+水解;Fe2++H2C2O4?FeC2O4↓+2H+;14.4;
(2)将FeC2O4氧化为K3[Fe(C2O4)3],最适宜作为“试剂a”是H2O2溶液,反应为 2FeC2O4+H2O2+3K2C2O4+H2C2O4═2K3[Fe(C2O4)3]↓+2H2O,温度较高时,H2O2分解,反应后煮沸即可过量的双氧水,其它氧化剂引入杂质,
故答案为:C;
(3)在天平的标尺上,1g之间有10个小格,一个小格代表的质量是0.1g,即天平的分度值为0.1g;被测物体的质量为20g+1.9g=21.9g,27.6克FeSO4•7H2O,物质的量为$\frac{27.6g}{276g/mol}$=0.1mol,根据铁原子守恒,理论生成K3[Fe(C2O4)3]•3H2O的物质的量为0.1mol,质量为:0.1mol×491g/mol=49.1g,产率=$\frac{实际产量}{理论产量}$×100%=$\frac{21.9g}{49.1g}$×100%≈44.6%,
故答案为:21.9;44.6%;
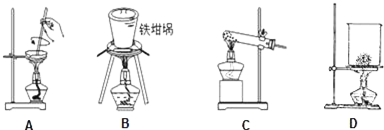
(4)某研究小组将K3[Fe(C2O4)3〕在一定条件下加热分解后,利用图3所示装置(可重复使用)确认所得含碳元素的气体产物为CO和CO2,先用D中的澄清石灰水检验二氧化碳,然后多余的二氧化碳用C中的NaOH溶液吸收,再用D中澄清石灰水检验是否吸收完全,然后通过B中的浓硫酸干燥,剩余的气体通过灼热的CuO,CO与CuO反应生成二氧化碳,最后二氧化碳通过D中澄清石灰水,则仪器连接顺序为:DCDBAD,若A中黑色粉末变为红色,其后D中澄清石灰水变浑浊,说明含有CO;
故答案为:DCDBAD;A中黑色粉末变为红色,其后D中澄清石灰水变浑浊.
点评 本题考查了物质制备实验过程分析判断,把握发生的化学反应及实验操作为解答的关键,侧重分析能力和计算能力的考查,注意信息与所学知识的结合,题目难度中等.


科目:高中化学 来源: 题型:推断题
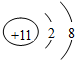 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能发生氧化反应 | |
| B. | 至少有三种同分异构体可以水解得到甲酸或甲醇 | |
| C. | 至少有三种同分异构体能与NaOH溶液反应 | |
| D. | 分子中含有碳碳双键或碳氧双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应式为CH4+10OH--8e-═CO32-+7H2O | |
| B. | 正极反应式为O2+2H2O+4e-═4OH- | |
| C. | 随着不断放电,电解质溶液碱性不变 | |
| D. | 甲烷燃料电池也可以用稀硫酸做电解质溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com