
| A、2种 | B、3种 | C、4种 | D、5种 |
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
| A、元素X的原子核内质子数为(2a2-1) |
| B、元素X形成的单质既能作氧化剂又能作还原剂 |
| C、元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数) |
| D、由元素X形成的某些化合物,可能具有杀菌消毒的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
| B、将氨通入盐酸溶液中:NH3+H+═NH4+ |
| C、在漂白粉溶液中通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D、将少量铜屑放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgO | B、CaO |
| C、KCl | D、MgS |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氦分子中含有共价键 |
| B、含有共价键的化合物一定是共价共价化合物 |
| C、离子化合物中可能含有极性共价键或非极性共价键 |
| D、同一元素的各种同位素的物理性质、化学性质均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
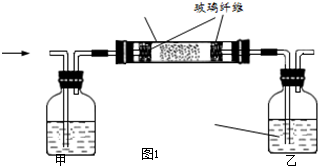

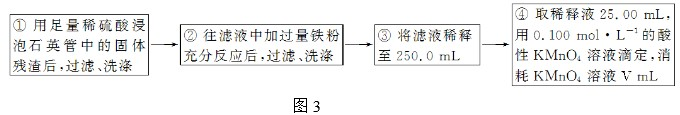
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com