
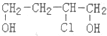 )是合成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂.
)是合成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂.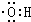 .
.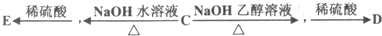
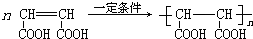 .
. 分析 (1)羟基中O原子含有1对共用电子对、2个孤对电子和1个孤电子;
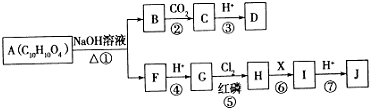
(2)A中含有醇羟基和氯原子,具有醇、卤代烃的性质,能发生取代反应、氧化反应、消去反应、酯化反应等;
(3)有机物A在Cu做催化剂和加热条件下,A中醇羟基被氧气氧化生成醛基,B结构简式为OHCCH2CH(Cl)CHO;
有机物B经氧化后生成有机物C,C的结构简式为HOOCCH2CH(Cl)COOH,C和氢氧化钠的水溶液发生取代反应然后酸化生成E,E的结构简式为HOOCCH2CH(OH)COOH,C和氢氧化钠的醇溶液发生消去反应然后酸化生成D,D的结构简式为HOOCCH=CHCOOH;
①E为2-羟基1,4-丁二酸;
②D发生加聚反应生成高分子化合物HPMA.
解答 解:(1)羟基中O原子含有1对共用电子对、2个孤对电子和1个孤电子,其结构简式为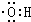 ,故答案为:
,故答案为: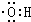 ;
;
(2)A中含有醇羟基和氯原子,具有醇、卤代烃的性质,能发生取代反应、氧化反应、消去反应、酯化反应等,因为不含不饱和键或苯环,所以不能发生加成反应,故选acd;
(3)有机物A在Cu做催化剂和加热条件下,A中醇羟基被氧气氧化生成醛基,B结构简式为OHCCH2CH(Cl)CHO;
有机物B经氧化后生成有机物C,C的结构简式为HOOCCH2CH(Cl)COOH,C和氢氧化钠的水溶液发生取代反应然后酸化生成E,E的结构简式为HOOCCH2CH(OH)COOH,C和氢氧化钠的醇溶液发生消去反应然后酸化生成D,D的结构简式为HOOCCH=CHCOOH;
①E为2-羟基1,4-丁二酸,其结构简式为HOOCCH2CH(OH)COOH,故答案为:HOOCCH2CH(OH)COOH;
②D发生加聚反应生成高分子化合物HPMA,反应方程式为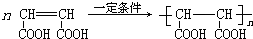 ,故答案为:
,故答案为: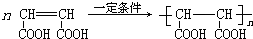 .
.
点评 本题考查有机物推断及有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,熟练掌握常见有机物官能团及其性质,注意醇或卤代烃发生消去反应时有机物特点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 实验中消耗的H2SO4物质的量为0.1mol | |
| D. | 溶液中金属离子物质的量为0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )| A. | 乙醇可以用来制饮料 | |
| B. | 1 mol乙醇完全燃烧时生成3mol水 | |
| C. | 1mol乙醇与足量的钠作用生成1g H2 | |
| D. | 物质的量相同的乙醇和乙烯气体完全燃烧,耗氧量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
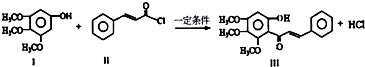
| A. | Ⅰ在空气中不能稳定存在 | |
| B. | 可用FeCl3溶液鉴别有机物Ⅱ和Ⅲ | |
| C. | Ⅱ中所有原子一定不可能共面 | |
| D. | 1mol产物Ⅲ与足量溴水反应,消耗Br2 的物质的量为1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| C. | 用酸性KMnO4溶液鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO | |
| D. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
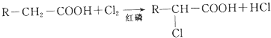
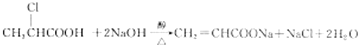 .
.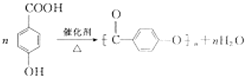 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应Ⅰ | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com