
分析 (1)反应中Fe失电子,Cu元素得到电子,化合价升高值=化合价降低值=转移电子数=2;
(2)反应中Cl得到电子同时Cl失去电子,化合价升高值=化合价降低值=转移电子数=1;
(3)反应中N得到电子同时N失去电子,化合价升高值=化合价降低值=转移电子数=15;
(4)反应中Cl失去电子同时Mn得到电子,化合价升高值=化合价降低值=转移电子数=2.
解答 解:(1)反应中Fe失电子,Cu元素得到电子,化合价升高值=化合价降低值=转移电子数=2,电子转移情况如下: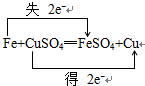 ;故答案为:
;故答案为: ;
;
(2)反应中Cl得到电子同时Cl失去电子,化合价升高值=化合价降低值=转移电子数=1,电子转移情况如下: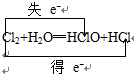 ;故答案为:
;故答案为: ;
;
(3)反应中N得到电子同时N失去电子,化合价升高值=化合价降低值=转移电子数=15,
电子转移情况如下: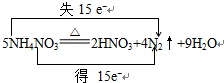 ;故答案为:
;故答案为: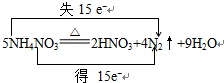 ;
;
(4)反应中Cl失去电子同时Mn得到电子,化合价升高值=化合价降低值=转移电子数=2,电子转移情况如下: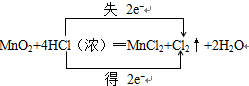 ;故答案为:
;故答案为: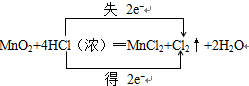 .
.
点评 本题考查氧化还原反应中转移电子数目,为高频考点,把握元素化合价变化及双线桥法表示转移电子的方向和数目为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L H2O含有的分子数为0.5NA | |
| B. | 常温常压下,14 g N2含有分子数为0.5 NA | |
| C. | 通常状况下,1NA个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液和胶体可以用丁达尔效应区分 | |
| B. | 将NaOH溶液与FeCl3溶液混合可制成Fe(OH)3胶体 | |
| C. | 鸡蛋白溶液、淀粉溶液、雾都是常见的胶体 | |
| D. | 溶液、胶体和浊液的本质区别是分散质微粒直径的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸镁与H2SO4反应 MgCO3+2H+=Mg2++H2O+CO2↑ | |
| B. | 向硝酸银溶液中加盐酸:Ag++Cl-=AgCl↓ | |
| C. | 铁与稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 澄清石灰水与盐酸的反应 H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物的分子式为C11H12O2 | |
| B. | 1mol该物质最多能与4molH2发生加成反应 | |
| C. | 该有机物一定条件下,可以发生取代、氧化、酯化反应 | |
| D. | 该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2还原CuO的反应只属于还原反应 | |
| B. | 置换反应都是氧化还原反应,所以3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2既是置换反应又是氧化还原反应 | |
| C. | 3O2$\frac{\underline{\;电火花\;}}{\;}$2O3是氧化还原反应 | |
| D. | 复分解反应一定不是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com