
| A. | CO2 | B. | CO | C. | O2 | D. | NO |
科目:高中化学 来源: 题型:选择题
| A. | 盐的电离平衡被破坏 | B. | 水的电离程度一定会增大 | ||
| C. | 溶液的pH一定会增大 | D. | c(H+)与c(OH-)的乘积一定会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
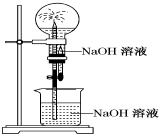
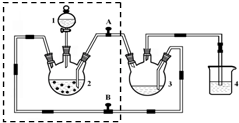 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| B. | Na的金属性比Cu强,故可用Na与CuSO4溶液反应制取Cu | |
| C. | 不能用带玻璃塞的玻璃瓶盛放碱液 | |
| D. | 玻璃、水泥、陶瓷、水晶都是重要的硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在氧气中燃烧 | B. | Ba(OH)2•8H2O与NH4Cl固体的反应 | ||
| C. | 铝片与稀盐酸的反应 | D. | 过氧化钠与水反应产生氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| P-P | P-O | P=O | O=O | |
| 键能 (kJ/mol) | a | b | c | d |
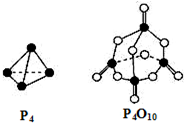
| A. | (4c+12b-6a-5d)kJ•mol-1 | B. | (6a+5d-4c-12b)kJ•mol-1 | ||
| C. | (4c+12b-4a-5d)kJ•mol-1 | D. | (4a+5d-4c-12b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com