
| A、在1L 2mol/L的硝酸溶液中含有的硝酸根离子数为4NA |
| B、标准状况下22.4L乙醇完全燃烧,生成的二氧化碳分子数为2NA |
| C、46g二氧化氮和46g四氧化二氮含有的原子数均为3NA |
| D、1mol氢氧根离子中含有的电子数为10NA |
| N |
| NA |
| m |
| M |
| N |
| NA |
| m |
| M |
| 46g |
| 46g/mol |
| 46g |
| 92g/mol |


科目:高中化学 来源: 题型:
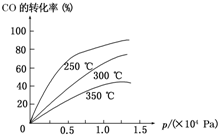 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇:| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蛋白质水解的最终产物是多肽 |
| B、淀粉水解的最终产物是葡萄糖 |
| C、纤维素不能水解成葡萄糖 |
| D、油脂水解产物之一是甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol?L-1) | 0.08 | 1.6 | 1.6 |
| A、此时刻反应达到平衡状态 |
| B、容器内压强不变时,说明反应达平衡状态 |
| C、平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变 |
| D、平衡时,反应混合物的总能量降低40kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiO2具有较好的导电性,可用于制造半导体材料 |
| B、H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| 达平衡时间/min | 40 | 10 | 30 |
| c(D)平衡/mol?L-1 | 0.5 | 0.5 | 0.15 |
| 反应的能量变化/KJ | Q1 | Q2 | Q3 |
| A、可用压强或密度是否发生变化判断上述反应是否达到平衡 |
| B、实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时υ(D)为0.01mol?L-1?min-1 |
| C、由表中信息可知Q>O,并显有Q3<Q2=Q1=Q |
| D、实验Ⅰ达平衡后,恒温下再向容器中通入1mol A和1mol D,达平衡时c(D)为1.0mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
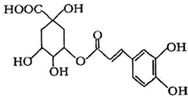
| A、分子中有可能所有碳原子共平面 |
| B、分子式为C16H18O9 |
| C、分子中含有醚键 |
| D、分子中有4个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2是还原产物 |
| B、KNO3被氧化 |
| C、转移电子的物质的量为5 mol |
| D、被氧化的N原子的物质的量为1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com