
分析 (1)甲烷燃烧生成二氧化碳和水,结合原子守恒配平书写化学方程式;
(2)燃烧11.2L(标准状况)甲烷,物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,结合化学方程式定量关系计算得到二氧化碳和水的物质的量;
解答 解:(1)甲烷在空气中完全燃烧的化学方程式为CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,
故答案为:CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O;
(2)燃烧11.2L(标准状况)甲烷,物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol
CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,
1 2 1 2
0.5mol 1mol 0.5mol 1mol
得到O2:1mol,CO2:0.5mol,H2O:1mol,
故答案为:1mol,0.5mol,1mol;
点评 本题考查了有机物燃烧化学方程式书写,化学方程式的计算分析应用,掌握基础是解题关键,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入适量BaCl2溶液后过滤 | B. | 加入适量NaOH溶液后过滤 | ||
| C. | 加入过量NaOH溶液后过滤 | D. | 加入过量Ba(OH)2溶液后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 透明的水溶液中:K+、Mg2+、SO42-、MnO4- | |
| B. | 含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ | |
| C. | 在pH=7的溶液中:Na+、Fe3+、SO42-、Br- | |
| D. | 强碱性溶液中:ClO-、S2-、HSO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  含0.01 mol NaOH和0.01 mol Ba(OH)2的混合溶液中缓慢通入CO2 | |
| B. |  KHCO3溶液中逐滴加入Ba(OH)2溶液 | |
| C. |  KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 | |
| D. |  向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

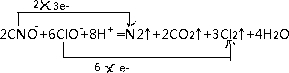 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有Br、Fe2+、I-的溶液中欲只氧化I-而不氧化Br、Fe2+,可用FeBr3作试剂 | |
| B. | 向Fel2溶液中通入少量Cl2,反应的离子方程式为:2Fe2++Cl2═2Fe3++2C1- | |
| C. | 向FeBr2溶液中通入足量Cl2,反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4CI- | |
| D. | 向FeCl2溶液中滴加足量碘水,能发生反应:2Fe2++12═2Fe3++2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,最简便的流程需要下列反应的顺序应是( )
,最简便的流程需要下列反应的顺序应是( )| A. | b、d、f、g、h | B. | e、d、c、a、h | C. | a、e、d、c、h | D. | b、a、e、c、f |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com