
| A、铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| B、实验室盛碱液的瓶子不用玻璃塞:SiO2+2OH-═SiO32-+H2O |
| C、用稀盐酸和大理石反应制取CO2:CO32-+2H+═CO2↑+H2O |
| D、向Ca(ClO)2溶液中通入过量CO2制取次氯酸:2ClO-+H2O+CO2═2HClO+CO32- |


科目:高中化学 来源: 题型:
 ,其分子式为
,其分子式为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 放电 |
| A、PbSO4的氧化性比PbO2的强、还原性比Pb的强 |
| B、放电时,PbO2为氧化剂、做负极,Pb为还原剂、做正极 |
| C、放电时,当有2mol H2SO4反应时,会有1.204×1024个电子从铅电极流出 |
| D、充电时,PbSO4既被氧化又被还原,Pb是阳极产物之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后所得红色固体能完全溶于稀硝酸,说明红色固体是铜 |
| B、用蒸馏水、酚酞、BaCl2溶液和已知浓度盐酸标准溶液作试剂,可测定NaOH固体(杂质仅为Na2CO3)的纯度 |
| C、将SO2气体通入溴水中,溴水颜色逐渐褪去,说明SO2具有漂白性 |
| D、已知Ksp(Ag2CrO4)=9.0×10-2,Ksp(AgCl)=1.8×10-10,说明Ag2CrO4的溶解度小于的溶解度小于AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
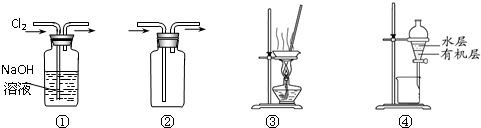
| A、装置①可用于除去Cl2中含有的少量HCl气体 |
| B、按装置②所示的气流方向可用于收集H2、NH3等 |
| C、用图③所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| D、用图④所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、A、B、C三点所表示的溶液中水的电离程度依次增大 |
| B、通入HCl,HA的电离常数减小,A-的水解程度增大 |
| C、加入1mol NaOH后,溶液中c(Na+)=c(A-) |
| D、未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B、用NaOH溶液滴定HY,当V(NaOH)=10mL时溶液中c(Y-)>c(Na+)>c(H+)>c(OH-) |
| C、用NaOH溶液滴定HY,当V(NaOH)=10mL时溶液中c(Na+)=c(Y-)+c(HY) |
| D、当三种酸均滴定至pH=7时,HZ所用NaOH溶液体积最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO(s) |
| B、CuO(s) |
| C、H2SO4(浓) |
| D、NaCl(s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com