
某同学为测定黄铜矿的纯度(主要成分CuFeS2含少量SiO2),设计如下实验:称取2.0g研细的该黄铜矿样品,高温下和空气中的氧气充分反应:
![]() 6CuFeS2+19O2
6CuFeS2+19O2![]() 6CuO+2Fe3O4+12SO2
6CuO+2Fe3O4+12SO2
生成的SO2进入D中和水发生反应:SO2+H2O=H2SO3;
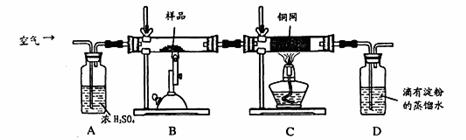
(1)称量该样品时用的仪器的名称为 。
(2)装置A的作用 ;
a.有利于空气中氧气充分反应 b.除去空气中的水份
c.有利于气体混合 d.有利于观察空气流速
(3)装置B中反应结束后,仍需继续通一段时间空气的目的 。
(4)实验后将D中的溶液全部转移至锥形瓶,用1.0mol/L的I2溶液进行滴定,反应为:H2SO3+I2+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)某同学为测定黄铜矿的纯度(主要成分CuFeS2含少量SiO2),设计如下实验:称取2.0g研细的该黄铜矿样品,高温下和空气中的氧气充分反应:
6CuFeS2+19O26CuO+2Fe3O4+12SO2
生成的SO2进入D中和水发生反应:SO2+H2O=H2SO3;
(1)称量该样品时用的仪器的名称为 。
(2)装置A的作用 ;
a.有利于空气中氧气充分反应 b.除去空气中的水份
c.有利于气体混合 d.有利于观察空气流速
(3)装置B中反应结束后,仍需继续通一段时间空气的目的 。
(4)实验后将D中的溶液全部转移至锥形瓶,用1.0mol/L的I2溶液进行滴定,反应为:H2SO3+I2+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)
查看答案和解析>>
科目:高中化学 来源:广东省惠州市2011届高三第一次调研考试(理综)化学部分 题型:实验题
(16分)某同学为测定黄铜矿的纯度(主要成分CuFeS2含少量SiO2),设计如下实验:称取2.0g研细的该黄铜矿样品,高温下和空气中的氧气充分反应: 6CuFeS2+19O2
6CuFeS2+19O2 6CuO+2Fe3O4+12SO2
6CuO+2Fe3O4+12SO2
生成的SO2进入D中和水发生反应:SO2+H2O=H2SO3;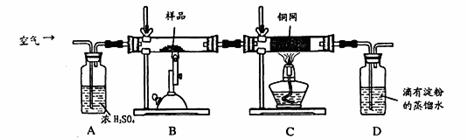
(1)称量该样品时用的仪器的名称为 。
(2)装置A的作用 ;
a.有利于空气中氧 气充分反应 b.除去空气中的水份
气充分反应 b.除去空气中的水份
c.有利于气体混合 d.有利于观察空气流速
(3)装置B中反应结束后,仍需继续通一段时间空气的目的 。
(4)实验后将D中的溶液全部转移至锥形瓶,用1.0mol/L的I2溶液进行滴定,反应为:H2SO3+I2 +H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)
+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)
查看答案和解析>>
科目:高中化学 来源:广东省惠州市2010-2011学年高三第一次调研考试(理综)化学部分 题型:实验题
(16分)某同学为测定黄铜矿的纯度(主要成分CuFeS2含少量SiO2),设计如下实验:称取2.0g研细的该黄铜矿样品,高温下和空气中的氧气充分反应:
6CuFeS2+19O2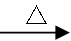 6CuO+2Fe3O4+12SO2
6CuO+2Fe3O4+12SO2
生成的SO2进入D中和水发生反应:SO2+H2O=H2SO3;
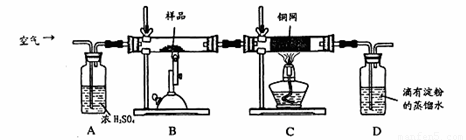
(1)称量该样品时用的仪器的名称为 。
(2)装置A的作用 ;
a.有利于空气中氧气充分反应 b.除去空气中的水份
c.有利于气体混合 d.有利于观察空气流速
(3)装置B中反应结束后,仍需继续通一段时间空气的目的 。
(4)实验后将D中的溶液全部转移至锥形瓶,用1.0mol/L的I2溶液进行滴定,反应为:H2SO3+I2+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com