
【题目】某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
A.1:2
B.1:4
C.3:4
D.3:2
科目:高中化学 来源: 题型:
【题目】某同学做了如下实验: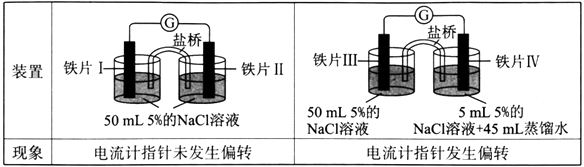
下列说法中正确的是( )
A.加热铁片I所在烧杯,电流表指针会发生偏转
B.用KSCN溶液检验铁片Ⅲ、IV附近溶液,可判断电池的正、负极
C.铁片I、Ⅲ的腐蚀速率相等
D.“电流计指针未发生偏转”,说明铁片I、铁片Ⅱ均未被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:
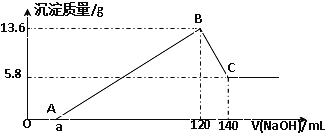
(1)写出OA段和BC段反应的离子方程式:
OA:________________________________ ; BC:_____________________________;
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
(5)a的值是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
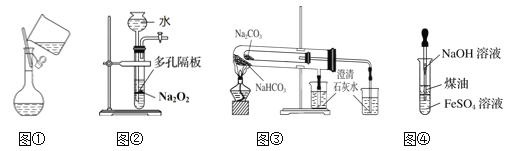
A. 图①向容量瓶中转移溶液
B. 图②用于Na2O2和H2O反应制取少量的O2
C. 图③比较碳酸钠和碳酸氢钠的热稳定性
D. 图④制备Fe(OH)2并能较长时间观察到白色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有H+、K+、Mg2+、Al3+、Fe3+、Cl-、SO![]() 、CO
、CO![]()
(1)取该溶液20 mL,加入NaOH溶液,只产生白色沉淀,且产生的沉淀量与加入1.0 mol·L-1NaOH溶液的体积之间的关系如图所示;水样中一定含有的阳离子是___________,其物质的量之比是_________,并可排除______的存在。
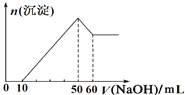
(2)另取该溶液20 mL,加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。试根据上述实验推测Cl-是否存在?___ (填“是”或“否”)。
(3)无法确定的离子是______,可通过____________方法确定其是否存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.则下列说法不正确的是( )
A.镁和铝的总质量为9 g
B.最初20 mL NaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 molL﹣1
D.生成的氢气在标准状况下的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答下列问题. 
(1)该反应是反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率(填“增大”“减小”“不变”),原因是;
(3)反应体系中加入催化剂对反应热是否有影响? , 原因是;
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 , E2(填“增大”“减小、”“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中所示物质或概念间的从属关系符合如图的是
X | Y | Z | |
A | 钠元素 | 主族元素 | 短周期元素 |
B | 电解质 | 化合物 | 纯净物 |
C | 氢氧化铁 | 胶体 | 分散系 |
D | 置换反应 | 氧化还原反应 | 放热反应 |
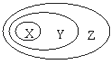
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com