
| A. | 在溴水中存在如下平衡:Br2+H2O?HBr+HBrO,当加入NaOH溶液后颜色变浅 | |
| B. | 对2NO2(g)?N2O4(g) 平衡体系,增加压强使颜色变浅 | |
| C. | 反应CO+NO2?CO2+NO△H<0升高温度使平衡向逆方向移动 | |
| D. | 向双氧水溶液中滴入FeCl3 溶液后,产生气泡速率加快 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.加入NaOH溶液后,NaOH和HBr、HBrO发生中和反应导致平衡正向移动,则溶液颜色变浅,能用平衡移动原理解释,故A不选;
B.增大压强,平衡正向移动,气体颜色变浅,能用平衡移动原理解释,故B不选;
C.该反应的正反应是放热反应,升高温度平衡逆向移动,所以能用平衡移动原理解释,故C不选;
D.氯化铁在双氧水的分解中作催化剂,只影响化学反应速率不影响平衡移动,所以不能用平衡移动原理解释,故D选;
故选D.
点评 本题考查平衡移动原理,为高频考点,明确平衡移动原理内涵及适用范围是解本题关键,注意:改变条件时不影响平衡移动的不能用平衡移动原理解释,易错选项是D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 现有X、Y、Z三种元素,已知有如下情况:
现有X、Y、Z三种元素,已知有如下情况:查看答案和解析>>
科目:高中化学 来源: 题型:解答题



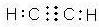



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 马口铁(镀锡铁)镀层破损铁的腐蚀速率加快 | |
| B. | 可以采用改变金属组成或结构的方法防止金属腐蚀 | |
| C. | 为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌快 | |
| D. | 为了防止钢铁设备腐蚀,利用外加电流的阴极保护法,应另附加一惰性电极,惰性电极作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 920kJ/mol | B. | 557kJ/mol | C. | 436kJ/mol | D. | 188kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 7.8 g Na2S和Na2O2中含有的阴离子数大于0.1NA | |
| C. | 56 g铁片投入足量浓硫酸中生成NA个SO2分子 | |
| D. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com