
| A. | 反应①是取代反应,反应②③是氧化还原反应 | |
| B. | 水中溶解的NH3会导致水生动物死亡 | |
| C. | 向氨超标的河水中加稀硫酸是一种行之有效的处理方法 | |
| D. | 自来水中的HgCl2可加入Na2S处理 |
分析 A.有机物分子中的原子或原子团被其它的原子或原子团所取代的反应为取代反应;有电子转移的化学反应是氧化还原反应,氧化还原反应的特征是有元素化合价升降;
B.氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致溶液呈碱性;
C.根据②③知,氨超标的河水呈酸性;
D.HgS是难溶性固体.
解答 解:A.反应①甲烷中的H原子被HgCl取代,所以为取代反应;②③中O、N元素都发生化合价变化,所以为氧化还原反应,故A正确;
B.氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而导致溶液呈碱性,有腐蚀性,所以水中溶解的NH3会导致水生动物死亡,故B正确;
C.根据②③知,氨超标的河水呈酸性,应该加入碱性物质,故C错误;
D.HgS是难溶性固体,所以自来水中的HgCl2可加入Na2S生成HgS沉淀,从而除去HgCl2,故D正确;
故选C.
点评 本题以信息为载体考查性质分析判断能力,侧重考查基本理论及元素化合物知识,明确取代反应及氧化还原反应概念及物质性质即可解答,易错选项是C.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:选择题
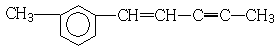 分子中,下列说法正确的是( )
分子中,下列说法正确的是( )| A. | 处于同一平面上的原子数最多可能有12个 | |
| B. | 1mol该分子最多可以与3molH2加成 | |
| C. | 该分子含有三种官能团 | |
| D. | 该物质能使溴水和高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若p>q,则还原性cCp-<dDq- | |
| B. | 若m>n,则碱性A(OH)m>B(OH)n | |
| C. | 若半径aAm+>bBn+,则a<b | |
| D. | 若半径aAm+>bBn+,则A的单质一定能从含Bn+的盐溶液中置换出B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素Y是ⅢA族的元素 | |
| C. | 元素X与氯形成化合物时,化学式可能是XCl | |
| D. | 若元素Y处于第3周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为以惰性电极进行电解:
如图为以惰性电极进行电解:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | ${\;}_{17}^{35}$Cl- 与${\;}_{17}^{37}$Cl属同位素 | |
| C. | 单质气体分子中不一定都具有共价键 | |
| D. | CaCl2晶体中既含有离子键又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.
欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物.有一位同学按气体的流动方向设计了一个实验流程,其所使用的试剂顺序可表示为:气体产物→无水硫酸铜固体→品红溶液→酸性高锰酸钾溶液→品红溶液→澄清石灰水.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
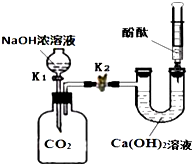 某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.
某兴趣小组在探究二氧化碳与氢氧化钠溶液反应的实验中,做了如图所示的实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com