
| A. | 乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理相同 | |
| B. | 交警用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生取代反应 | |
| C. | 乙酸的分子式为C2H4O2,属于弱酸 | |
| D. | 苯分子中没有碳碳双键,因此苯不能发生加成反应 |
分析 A.乙烯含碳碳双键,与溴水发生加成反应、与高锰酸钾发生氧化反应;
B.乙醇含-OH,能被重铬酸钾氧化;
C.乙酸的分子式为C2H4O2,在水中不能完全电离;
D.苯无双键,为不饱和烃,可与氢气发生加成反应.
解答 解:A.乙烯含碳碳双键,与溴水发生加成反应、与高锰酸钾发生氧化反应,褪色的原理不同,故A错误;
B.乙醇含-OH,能被重铬酸钾氧化,则用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生氧化反应,故B错误;
C.乙酸的分子式为C2H4O2,在水中不能完全电离,为弱酸,故C正确;
D.苯无双键,为不饱和烃,可与氢气发生加成反应生成环己烷,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 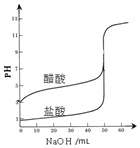 表示分别用NaOH溶液滴定等浓度等体积的盐酸和醋酸溶液反应变化曲线,指示剂都可用酚酞 | |
| B. |  表示分别用等浓度AgNO3溶液滴定等浓度等体积的NaCl、NaBr及NaI溶液反应变化曲线,c为I- | |
| C. | 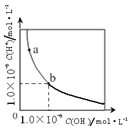 表示一定温度下,水溶液中H+和OH-的浓度变化曲线,b→a可能是加CuCl2溶液导致的 | |
| D. | 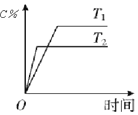 表示其他条件不变时,可逆反应A(g)+3B(g)?2C(g)△H<0,C的物质的量分数与温度的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl═H++Cl- | B. | H2O═H++OH- | ||
| C. | Na2CO3?2Na++CO32- | D. | NH3•H2O═NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CO32-) | B. | c(Ca2+) | C. | c(H+) | D. | Ksp(CaCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2、NH3的浓度相等 | |
| B. | 容器内压强不再变化 | |
| C. | 单位时间内消耗a mol N2,同时生成2a mol NH3 | |
| D. | 容器内混合气体密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 共价键 | 键能/kJ•mol-1 |
| H-H | 436 |
N≡N | 946 |
| N-H | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2 mol SO2与足量O2反应,可制备2 mol SO3 | |
| B. | 一定条件下,1 mol N2与3 mol H2反应,可制备1.0 mol NH3 | |
| C. | 10 mL 18.0 mol/L 的H2SO4与足量铜加热反应,可制备0.09 mol SO2 | |
| D. | 含4 mol HCl的浓盐酸与足量MnO2加热反应,可制备1 mol Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人误食亚硝酸钠中毒时,不可以服用氢碘酸解毒 | |
| B. | 该反应中氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 向反应所得的混合溶液中加入稀硫酸和亚硝酸钠,I-不可能转化为I2 | |
| D. | 当有2molHI被氧化时,转移电子数是2NA(设NA为阿伏加德罗常数的值) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com