
��һ���̶��ݻ����ܱ������У��������»�ѧ��Ӧ��CO��g��+H2O��g�� ![]() CO2��g��+H2��g������H��QkJ?mol��1���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ����
CO2��g��+H2��g������H��QkJ?mol��1���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ����
| t/�� | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.25 |
��ش�
��1��������Ӧ��Q 0��ѡ�����������
��2�����жϸ÷�Ӧ�Ѵﵽ��ѧƽ��״̬�������� ��
a.������ѹǿ���� b. ��H����
c. v����H2����v����CO�� d. CO��������������
��3���¶�Ϊ850��ʱ�����淴Ӧ��CO��g��+H2O��g�� ![]() CO2��g��+H2��g���ڹ̶��ݻ����ܱ������н��У������ڸ����ʵ�Ũ�ȱ仯���±���
CO2��g��+H2��g���ڹ̶��ݻ����ܱ������н��У������ڸ����ʵ�Ũ�ȱ仯���±���
850��ʱ�����ʵ�Ũ�ȣ�mol?L��1�� �仯
| ʱ�䣨min�� | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
�ټ��㣺0��4minʱv��CO��=________mol/��L?min����H2O��g����ת���ʣ� ��
�ڷ�Ӧ��4min~5min�䣬ƽ�����淴Ӧ�����ƶ������ܵ�ԭ����________����ѡ��������5min~6min֮����ֵ�����仯�����ܵ�ԭ����___________����ѡ����
a.����ˮ���� b.�����¶� c.ʹ�ô��� d.��������Ũ��
 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2C��g������ʼ����1molA��2molB����Ӧ�ﵽƽ�����C��Ũ��Ϊp mol/L����C���������Ϊ�أ�����ͬ�����£�
2C��g������ʼ����1molA��2molB����Ӧ�ﵽƽ�����C��Ũ��Ϊp mol/L����C���������Ϊ�أ�����ͬ�����£�| 1 |
| 2 |
| 1 |
| 2 |
 2SO3��g����������Ӧ�Ƿ��ȷ�Ӧ�����ﵽƽ���������������ʱ��ֻ�ı����е�ijһ�����������仯�����������С�����䣩����ո��У�
2SO3��g����������Ӧ�Ƿ��ȷ�Ӧ�����ﵽƽ���������������ʱ��ֻ�ı����е�ijһ�����������仯�����������С�����䣩����ո��У��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧѧ���е�ƽ��������Ҫ���ݰ�������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ������֣��Ҿ�������������ԭ������ش��������⣮
��ѧѧ���е�ƽ��������Ҫ���ݰ�������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ������֣��Ҿ�������������ԭ������ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
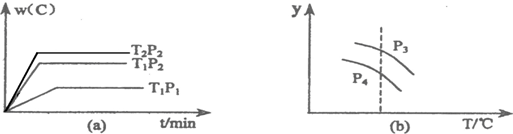
| A��P3��P4��y���ʾA��ת���� | B��P3��P4��y���ʾB��������� | C��P3��P4��y���ʾ��������ƽ����Է������� | D��P3��P4��y���ʾ���������ܶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��a��b��c=m��n��p | ||||||
B��a��b=m��n��
| ||||||
C��
| ||||||
D��a=
|
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com