
| A. | ①②⑥ | B. | ①②⑤ | C. | ②⑤③ | D. | ①②③ |
分析 由不同非金属元素形成的化学键为极性键,由同种非金属元素形成的化学键为非极性键,只含非极性键的分子为非极性分子;若分子含有极性键,但结构对称,正负电荷的中心重合,则为非极性分子,极性分子中正负电荷的中心不重合,具有一定的极性,以此来解答.
解答 解:①BF3中含有极性键,为平面三角形分子,正负电荷重心重叠,为非极性分子,
②CCl4中含有极性键,空间结构为正四面体,正负电荷的中心重合,为非极性分子,
③NH3中含有极性键,空间结构为三角锥形,正负电荷的中心不重合,为极性分子,
④H2O中含有极性键,空间结构为V型,为极性分子;
⑤HCl中含有极性键,空间结构为直线形,正负电荷的中心不重合,为极性分子,
⑥CO2中含有极性键,空间结构为直线形,正负电荷的中心重合,为非极性分子;
故选A.
点评 本题考查极性键和非极性键,熟悉常见元素之间的成键是解答本题的关键,注意化学键、空间构型与分子的极性的关系来分析解答即可,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯可以用作有机溶剂 | |
| B. | 苯分子的结构简式可表示为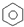 | |
| C. | 苯是单键与双键交替组成的环状结构 | |
| D. | 苯燃烧时能产生大量黑烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| B. | pH=12的Ba(OH)2溶液和pH=12的NaHCO3溶液中,水电离的c(H+)相等 | |
| C. | 将0.2 mol•L-1 NaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后c(OH-)<c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:
氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:| A. | 反应开始时速率增大可能是c(H+)所致 | |
| B. | 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合 | |
| C. | 纵坐标为v(H+)的v-t曲线与图中曲线完全重合 | |
| D. | 后期反应速率下降的主要原因是反应物浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲为K2SO4溶液 | B. | 乙为K2CO3溶液 | C. | 戊为Fe(NO3)3溶液 | D. | 丁为(NH4)2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com