
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
【答案】1s22s22p63s23p63d5或[Ar]3d5 N>O>S sp2 分子晶体 正四面体形 10 CN-或C22- 3:1 12  ×1010
×1010
【解析】
(1)铁为26号元素,电子排布式为1s22s22p63s23p63d64s2,失去4s能级上的2个电子,形成Fe2+,再失去3d能级上的1个电子后形成Fe3+;
(2)同周期从左向右第一电离能逐渐增大,同主族从上到下第一电离能逐渐减小;苯酚可看成分子中的一个氢原子被羟基取代,苯和苯酚均为平面结构,碳原子均为sp2杂化;
(3)分子晶体熔沸点较低且熔融状态不导电;根据SO42-中心原子含有的共价键个数与孤电子对数之和确定空间构型;
(4)配合物中碳原子不存在孤电子对,σ键由2个,即1个Fe(CO)5中含有10个σ键;原子数目相等,价电子总数相等的微粒为等电子体;
(5)氮化铁晶体为六棱柱,顶点为6个晶胞共有,面心的点为2个晶胞共有,晶胞中12个铁原子位于顶点,2个铁原子位于面心,3个铁原子位于内部,2个氮原子位于内部,因此据此可计算微粒个数比;
(6)以Fe2+顶点研究,与Fe2+紧邻且等距离的Fe2+处于面心,每个顶点为8个晶胞共用,每个面为2个晶胞共用;Fe2+与O2-的最短核间距等于晶胞棱长的![]() ,均摊法计算晶胞中Fe2+与O2-的离子数目,计算出晶胞的质量,与密度公式结合进行计算。
,均摊法计算晶胞中Fe2+与O2-的离子数目,计算出晶胞的质量,与密度公式结合进行计算。
(1)铁原子失去4s能级上的2个电子和3d能级上的1个电子后形成Fe3+,因此基态Fe3+的电子排布式为1s22s22p63s23p63d5或[Ar]3d5;
(2)同主族从上到下第一电离能逐渐减小,即第一电离能O>S,同周期从左向右第一电离能逐渐增大,但氮元素2p能级处于半满的稳定状态,能量低,因此第一电离能N>O,所以第一电离能N>O>S;苯酚可看成分子中的一个氢原子被羟基取代,苯和苯酚均为平面结构,碳原子均为sp2杂化
(3)FeCl3的熔点为306℃,沸点为315℃,熔沸点较低,属于分子晶体;SO42-中心S原子的σ键电子对数为4,中心原子孤电子对数为0,价层电子对数为4,立体构型为正四面体形;
(4)配合物中碳原子不存在孤电子对,σ键由2个,即1个Fe(CO)5中含有10个σ键,那么1 mol Fe(CO)5分子中含10molσ键;原子数目相等,价电子总数相等的微粒为等电子体,与CO互为等电子体的离子有CN-或者C22-;
(5)氮化铁晶体为六棱柱,顶点为6个晶胞共有,面心的点为2个晶胞共有,晶胞中12个铁原子位于顶点,2个铁原子位于面心,3个铁原子位于内部,2个氮原子位于内部,因此晶胞中含有铁微粒12×![]() +2×
+2×![]() +3=6,氮微粒的个数为2,所以铁、氮的微粒个数之比为6:2=3:1;
+3=6,氮微粒的个数为2,所以铁、氮的微粒个数之比为6:2=3:1;
(6)以Fe2+顶点研究,与Fe2+紧邻且等距离的Fe2+处于面心,每个顶点为8个晶胞共用,每个面为2个晶胞共用,因此与Fe2+紧邻且等距离的Fe2+数目为![]() =12个;晶胞中Fe2+共8×
=12个;晶胞中Fe2+共8×![]() +6×
+6×![]() =4,O2-的数目为1+12×
=4,O2-的数目为1+12×![]() =4,晶胞的质量为
=4,晶胞的质量为![]() ,Fe2+与O2-的最短核间距等于晶胞棱长的
,Fe2+与O2-的最短核间距等于晶胞棱长的![]() ,设最短距离为xpm,则晶胞的棱长为2xpm,那么
,设最短距离为xpm,则晶胞的棱长为2xpm,那么![]() =ρ(2x×10-10)3,解得x=
=ρ(2x×10-10)3,解得x= ×1010pm。
×1010pm。


科目:高中化学 来源: 题型:
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如下图所示(EMI+为有机阳离子)。
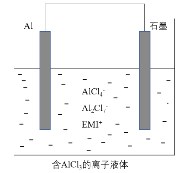
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1= a kJ·mol-1
②3AlCl(g) = 2Al(l)+ AlCl3(g) △H2= b kJ·mol-1
③Al2O3(s)+3C(s) = 2Al(l)+3CO(g) △H3
下列说法正确的是
A.该电池的电解质可用氯化铝水溶液替代
B.Al2O3(s)+3C(s) = 2Al(l)+3CO(g) △H3= (a-b) kJ·mol-1
C.该电池充电时石墨电极与电源正极相连
D.该电池放电时的负极反应方程式为 :Al-3e-+7AlCl4-=4Al2Cl7-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关描述不正确的是
A.新制饱和氯水和浓硝酸光照下均会有气体产生,其成分中都有氧气
B.灼烧NaOH固体时不能使用瓷坩埚,因为瓷坩埚中的SiO2能与NaOH反应
C.钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同
D.浓硫酸具有较强酸性,能与Cu反应生成H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是
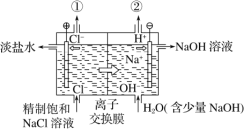
A.装置中发生反应的离子方程式为2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
B.装置中出口①处的物质是氯气,出口②处的物质是氢气
C.该离子交换膜只能让阳离子通过,不能让阴离子通过
D.该装置是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以葡萄糖为燃料的微生物燃料电池结构示意图。关于该电池的叙述不正确的是( )
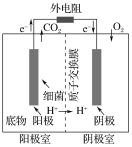
A.该电池不能在高温下工作
B.电池的负极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,电子从正极区向负极区每转移1 mol,便有1 mol H+从阳极室进入阴极室
D.微生物燃料电池具有高能量转换效率、原料较广泛、操作条件温和、有生物相容性等优点,值得研究与推广
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 是五种原子序数依次增大的前四周期元素。A、B、C是位于p区的同一周期的元素,C的价层电子排布为nsnnp2n,A与C原子核外的未成对电子数相等;DC2与BC2-为等电子体;E为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)E在周期表中的位置_____。
(2)与 E同区、同周期元素原子的价电子排布式是_____;C2-的电子排布图________。
(3)A、B、C均可与氢元素形成氢化物,它们的最简单氢化物稳定性由强到弱的排列顺序____ (填分子式)。
(4)A、B、C的最简单氢化物中,键角由大到小的顺序为_____(用分子式表示),其中 B的最简单氢化物的 VSEPR模型名称为_____,C的最简单氢化物的分子立体构型名称为________。
(5)A、C 两种元素能形成化合物 AC2,该分子的结构式_____,中心原子的杂化轨道类型_________ ,根据电子云重叠方式的不同,分子里共价键的类型有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图的说法不正确的是( )

A.1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时,需要吸收12 kJ的能量
C.1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成2HI(g)的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)CH3OH(g)。

根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=__________,升高温度,K值__________(填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是__________(填字母序号)。
a.氢气的浓度减小 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com