
【题目】金属钼(Mo)在工业和国防建设中有重要的作用。钼的常见化合价为+4、+5、+6。由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(![]() ),部分流程如下图所示:
),部分流程如下图所示:
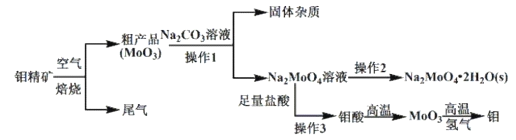
已知:钼酸微溶于水,可溶于碱溶液。
回答下列问题:
(1)钼精矿在空气中焙烧时,发生的主要方程式为_______________________。
(2)钼精矿焙烧时排放的尾气对环境会产生危害,请你提出一种实验室除去该尾气的方法________________________。
(3)操作2的名称为_____________________ 、过滤、洗涤、干燥。
(4)实验室由钼酸经高温制MoO3,所用到的硅酸盐材料仪器的名称是_________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(![]() )=0.80 molL1、c(
)=0.80 molL1、c(![]() )=0.05 molL1,在结晶前需加入Ba(OH)2固体以除去溶液中的
)=0.05 molL1,在结晶前需加入Ba(OH)2固体以除去溶液中的![]() 。当BaMoO4开始沉淀时,SO42的去除率是_________。[Ksp(BaSO4)=1.1
。当BaMoO4开始沉淀时,SO42的去除率是_________。[Ksp(BaSO4)=1.1![]() 1010、Ksp(BaMoO4)=4.0
1010、Ksp(BaMoO4)=4.0![]() 108,溶液体积变化可忽略不计。]
108,溶液体积变化可忽略不计。]
(6)焙烧钼精矿所用装置是多层焙烧炉,下图为各炉层固体物料的物质的量的百分数(![]() )。
)。
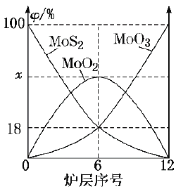
①x=___________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2,还原剂为_________。若反应中转移3mole-,则消耗的还原剂的物质的量为______________。
【答案】2MoS2+7O2 ![]() 2MoO3+4 SO2 可用氨水或氢氧化钠溶液吸收等其他合理答案 蒸发浓缩、冷却结晶 坩埚 95.6% 64 MoS2 0.25mol
2MoO3+4 SO2 可用氨水或氢氧化钠溶液吸收等其他合理答案 蒸发浓缩、冷却结晶 坩埚 95.6% 64 MoS2 0.25mol
【解析】
钼精矿(主要成分是MoS2)在空气中焙烧时生成MoO3和SO2,SO2会污染环境,粗产品MoO3在碳酸钠溶液中反应生成![]() ,经过一系列操作得到钼酸钠晶体(
,经过一系列操作得到钼酸钠晶体(![]() ),
),![]() 溶液加入足量盐酸生成钼酸,钼酸高温分解得到MoO3,MoO3与氢气在高温下反应生成Mo。
溶液加入足量盐酸生成钼酸,钼酸高温分解得到MoO3,MoO3与氢气在高温下反应生成Mo。
(1)钼精矿在空气中焙烧时生成MoO3和SO2,发生的主要方程式为2MoS2+7O2 ![]() 2MoO3+4 SO2;故答案为:2MoS2+7O2
2MoO3+4 SO2;故答案为:2MoS2+7O2 ![]() 2MoO3+4 SO2。
2MoO3+4 SO2。
(2)钼精矿焙烧时排放的尾气对环境会产生危害,主要是二氧化硫会污染环境,一种实验室除去该尾气的方法是可用氨水或氢氧化钠溶液吸收;故答案为:可用氨水或氢氧化钠溶液吸收等(其他合理答案)。
(3)操作2是从溶液变为晶体,因此名称为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)实验室由钼酸经高温煅烧制的MoO3,所用到的硅酸盐材料仪器的名称是坩埚;故答案为:坩埚。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(![]() )=0.80 molL1、c(
)=0.80 molL1、c(![]() )=0.05 molL1,在结晶前需加入Ba(OH)2固体以除去溶液中的
)=0.05 molL1,在结晶前需加入Ba(OH)2固体以除去溶液中的![]() 。当BaMoO4开始沉淀时,Ksp(BaMoO4)=4.0×108=0.80×c(Ba2+),此时钡离子浓度为c(Ba2+)=5.0×108 molL1,则根据Ksp(BaSO4)=1.1×1010=5.0×108×c(
。当BaMoO4开始沉淀时,Ksp(BaMoO4)=4.0×108=0.80×c(Ba2+),此时钡离子浓度为c(Ba2+)=5.0×108 molL1,则根据Ksp(BaSO4)=1.1×1010=5.0×108×c(![]() ),此时硫酸根浓度为c(
),此时硫酸根浓度为c(![]() )=2.2×103 molL1,
)=2.2×103 molL1,![]() 的去除率是
的去除率是![]() ;故答案为:95.6%。
;故答案为:95.6%。
(6)①由图中信息可知,6层中存在的固体物质分别为MoS2、MoO3、MoO2,图像分析MoS2、MoO3的物质的量百分比均为18%,根据Mo元素守恒,则MoO2的物质的量百分比为64%;故答案为:64%。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2,反应为MoS2 + 6MoO3 ![]() 7MoO2 + 2SO2,MoS2中S化合价升高,MoO3中Mo化合价降低,1mol MoS2反应转移12mol电子,因此还原剂为MoS2。若反应中转移3mole-,则消耗的还原剂的物质的量为
7MoO2 + 2SO2,MoS2中S化合价升高,MoO3中Mo化合价降低,1mol MoS2反应转移12mol电子,因此还原剂为MoS2。若反应中转移3mole-,则消耗的还原剂的物质的量为![]() ;故答案为:0.25mol。
;故答案为:0.25mol。


科目:高中化学 来源: 题型:
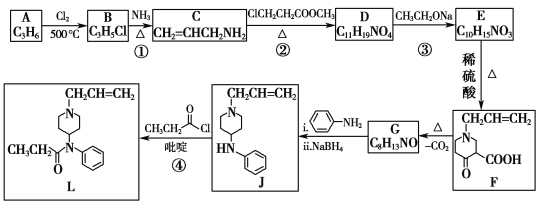
【题目】芬太尼类似物L具有镇痛作用,它的合成方法如图:
已知:
Ⅰ.![]() +Cl—R3
+Cl—R3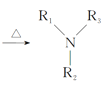 +HCl
+HCl
Ⅱ.R1COOR2+R3CH2COOR4![]()
![]() +R2OH
+R2OH
Ⅲ.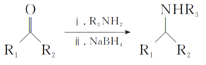 (R1、R2、R3、R4为氢原子或烃基)
(R1、R2、R3、R4为氢原子或烃基)
Ⅳ.RCH=CHR′![]() RCOOH+R′COOH,R、R′为烃基。
RCOOH+R′COOH,R、R′为烃基。
回答下列问题:
(1)A是一种烯烃,化学名称为__,其分子中最多有__个原子共面。
(2)B中官能团的名称为__、__。②的反应类型为__。
(3)③的化学方程式为__。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子。用星号(*)标出F中的手性碳原子__。G的结构简式为__,符合以下条件的G同分异构体有___种。
①能发生银镜反应
②结构中只含有一个环,该环结构为![]() ,环上只有一个侧链
,环上只有一个侧链
(5)已知④有一定的反应限度,反应进行时加入吡啶(一种有机碱),其作用是__。
(6)参照上述合成路线,写出以环己烯(![]() )和乙醇为起始原料制备化合物
)和乙醇为起始原料制备化合物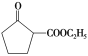 的合成路线(其他试剂任选)。___。
的合成路线(其他试剂任选)。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)![]() 2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为______。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______.
A.消耗1molN2同时生成1molO2![]() 混合气体密度不变
混合气体密度不变
C.混合气体平均相对分子质量不变D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态![]() 与原平衡状态相比,此时平衡混合气中NO的体积分数______
与原平衡状态相比,此时平衡混合气中NO的体积分数______![]() 填“变大”、“变小”或“不变”
填“变大”、“变小”或“不变”![]()
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示不正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
B.C(金刚石,s)=C(石墨,s) △H=-1.19kJ·mol-1,所以石墨比金刚石稳定
C.含1mol H2SO4的浓硫酸与足量的NaOH溶液反应,放出热量为57.3kJ
D.在101 kPa下,2 g H2 完全燃烧生成液态水放出285.8kJ热量,其热化学方程式为H2(g)+![]() O2
O2![]() H2O(l) △H=-285.8kJ·mol-1
H2O(l) △H=-285.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O。
CH3CH2OCH2CH3+H2O。
(乙醚制备)装置设计如图(部分装置略)
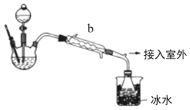
(1)仪器b应更换为下列的___(填序号)。
A.干燥器 B.直形冷凝管 C.玻璃管 D.安全瓶
(2)反应温度控制在145℃,还需添加___以防止局部过热,若温度过高,会生成一种能催熟果实的气体,则副反应化学方程式为:___。
(3)反应时,若滴入乙醇的速率显著超过馏出液速率,反应速率会降低,可能原因是___。
(乙醚提纯)
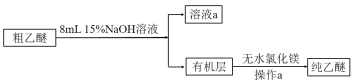
(4)粗乙醚中含有的主要杂质为___;操作a的名称是___;无水氯化镁的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用乙醇和甲苯为原料进行人工合成,其合成路线如图:
)是其中的一种,它可以从茉莉花中提取,也可以用乙醇和甲苯为原料进行人工合成,其合成路线如图:
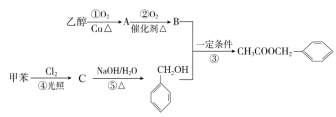
(1)C的结构简式是___,⑤的反应类型:___。
(2)A中所含官能团名称是___,以下化合物在一定条件下,能生成与A中物质相同官能团的是___(填序号),能发生消去反应生成两种烯烃的是___(填序号)
a.![]() b.
b.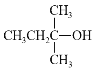 c.
c. d.
d.
(3)①的化学方程式为___;③的化学方程式为___。
(4)乙酸苯甲酯![]() 有多种同分异构体,其中在苯环上只有一个支链,属于酯类化合物的同分异构体还有___种,其中在酸性条件下水解生成甲酸的同分异构体是:___。
有多种同分异构体,其中在苯环上只有一个支链,属于酯类化合物的同分异构体还有___种,其中在酸性条件下水解生成甲酸的同分异构体是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合氢化物可作为储氢和固体电解质材料,在能源与材料领域得到了深入的研究。
如:①Mg(NH2)2 ②NaNH2 ③ H3N-BH3 ④NaAlH4 ⑤Li3AlH6
(1)复合氢化物升温加热可逐步分解放出氢气,理论上单位质量的上述复合氢化物其储氢能力最低的是__________(填标号)。
(2)在Mg(NH2)2和NaNH2中均存在NH2-,NH2-的空间构型为_________,中心原子的杂化方式为____________。
(3)H3N-BH3与水反应生成一种盐和H2的化学方程式:_____________________。写出基态B原子的价电子轨道表达式:__________________________。
(4)Li3AlH6晶体的晶胞参数为a=b=801.7 pm,c=945.5 pm,α=β=90°、γ=120°,结构如图所示:
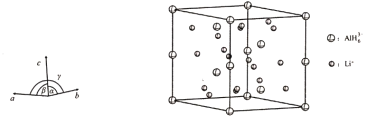
①已知AlH63-的分数坐标为(0,0,0)、(0,0,![]() ),(
),(![]() ,
,![]() ,
,![]() ),(
),(![]() ,
,![]() ,
,![]() ),(
),(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() ),晶胞中Li+的个数为____________。
),晶胞中Li+的个数为____________。
②如图是上述Li3AlH6晶胞的某个截面,共含有10个AlH63-,其中6个已经画出(图中的○),请在图中用○将剩余的AlH63-画出____________。
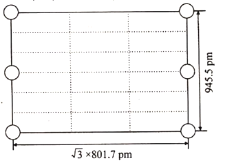
③此晶体的密度为____g·cm-3(列出计算式,已知阿伏加德罗常数约为6.02×1023mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的成分主要为 FeCr2O4 ,另含有少量 Al2O3 和 SiO2 。从铬铁矿中提取铁、铬的化合物,并获得副产物的工艺流程如下:
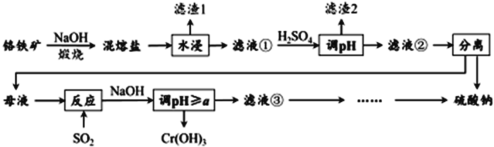
已知:铬铁矿FeCr2O4 中Cr元素在化合价为+3,“ 混熔盐 ” 中含有 Na2CrO4 和 NaFeO2 等成分,其中 NaFeO2 极易水解。试回答下列问题:
(1) “滤渣 1 ”为红褐色沉淀,其化学式为 _________________ ;
(2) 向滤液①中加 H2SO4 “调“ pH ”的目的:一是使 CrO![]() 转化为 Cr2O
转化为 Cr2O![]() ,离子方程式为 __________________ ;二是______________ 。
,离子方程式为 __________________ ;二是______________ 。
(3) “煅烧”铬铁矿时,主要成分反应的化学方程式为 _____________________ 。
(4) 根据下图溶解度(S)~温度(T) 曲线判断,
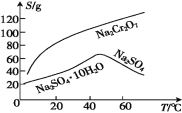
对滤液②进行的最佳“分离”方法为 ________( 填序号 ) 。
A. 蒸发结晶 B. 蒸发浓缩,趁热过滤 C. 蒸发浓缩,冷却结晶,过滤
(5) “反应”的离子方程式为 ____________________________ 。
(6) 已知 25 ℃时,Cr(OH) 3 的溶度积常数 Ksp [Cr(OH) 3 ]= 1.0 × 10 -32 。则使 Cr 3+恰好完全沉淀,即溶液中c(Cr 3+ )=1.0 × 10 -5 mol/L 时,应调节pH 的最小值a为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com