
A、CO2的分子模型示意图 | ||
B、甲烷的电子式 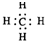 | ||
| C、硫离子的核外电子排布式 1s22s22p63s23p6 | ||
D、碳-12原子构成
|
 ,故A错误;
,故A错误;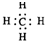 ,故B正确;
,故B正确; ,则硫离子的核外电子排布式为:1s22s22p63s23p6,故C正确;
,则硫离子的核外电子排布式为:1s22s22p63s23p6,故C正确;12 6 |


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:

| A、反应前后原子的种类和数目可能改变 |
| B、该反应若有热量变化,则一定是氧化还原反应 |
| C、若该反应为放热反应,则不需加热反应就一定能进行 |
| D、该反应遵循能量守恒,所以一定有能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠浮在水面,熔化成银色光亮的小球 |
| B、钠贮存在煤油中 |
| C、所得溶液的质量分数为2.25% |
| D、反应中转移0.1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2 |
| B、HCl |
| C、Cl2 |
| D、F2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若降低温度,可以减慢反应速率 |
| B、催化剂既能加快化学反应速率,又能提高SO2的转化率 |
| C、氧气足量时,SO2不能完全转化为SO3 |
| D、达到平衡时,SO2和SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3- |
| B、SO32- |
| C、CO32- |
| D、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |
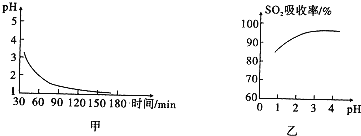
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com