
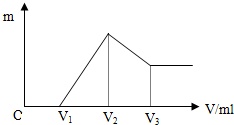
 将0.1mol的镁、铝混合物溶于100ml 4mol/L的盐酸中,然后滴加NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量m随加入NaOH溶液的体积V变化的关系如图所示.
将0.1mol的镁、铝混合物溶于100ml 4mol/L的盐酸中,然后滴加NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量m随加入NaOH溶液的体积V变化的关系如图所示.分析 (1)由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:H++OH-=H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为V2时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为氯化钠溶液;
再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O;
(2)V2时沉淀达到最大量,此时溶质为氯化钠,根据氯原子守恒计算出氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算出氢氧化钠溶液的浓度;
(3)由图可知,0~V1发生H++OH-=H2O,V1~V2发生Mg2+、Al3+转化为沉淀的反应,V2~V3段发生Al(OH)3+OH-=AlO2-+2H2O,结合反应及原子守恒计算解答.
解答 解:(1)由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:H++OH-=H2O;继续滴加NaOH溶液,到氢氧化钠溶液为V2时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为氯化钠溶液;再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应为:Al(OH)3+OH-=AlO2-+2H2O,
故答案:H++OH-=H2O;Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(2)V2时沉淀达到最大量,此时溶质为NaCl,根据氯原子守恒可知:n(NaOH)=n(HCl)=4mol/L×0.1L=0.4mol,则该氢氧化钠溶液浓度为:$\frac{0.4mol}{0.4L}$=1mol/L,
故答案为:1;
(3)若V1=160mL,说明盐酸有剩余,剩余盐酸的物质的量为:1mol/L×0.16L=0.16mol,则和金属反应的盐酸的物质的量为:4mol/L×0.1L-0.16mol=0.24mol,
设镁的物质的量是x,铝的物质的量是y,则:x+y=0.1mol,2x+3y=0.24,解得x=0.06mol,y=0.04mol,
即镁的物质的量为0.06mol,铝的物质的量为0.04mol;
V3点时溶液中的溶质是偏铝酸钠和氯化钠,根据原子守恒知,n(NaOH)=n(Al)+n(HCl)=0.04mol+0.4mol=0.44mol,所以氢氧化钠的体积为:$\frac{0.44mol}{1mol/L}$=0.44L=440mL,
故答案为:0.06; 0.04;440.
点评 本题以图象形式考查混合物计算,题目难度中等,明确每一段图象发生的化学反应及拐点代表的含义、溶液中溶质的成分为解答关键,然后结合方程式对有关问题进行分析,注意守恒思想的运用.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| B. | CaO+H2O=Ca(OH)2 | |
| C. | CaCO3 $\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | |
| D. | CH3CH2OH(酒精)+3O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2+3 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将某无色气体通入品红溶液中,品红溶液褪色,则此气体一定是SO2 | |
| B. | 取少许某溶液并滴加数滴硫氰化钾溶液,无明显现象,再滴加数滴H2O2溶液,溶液变血红色,则原溶液中一定含Fe2+ | |
| C. | 在硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) | |
| D. | 在淀粉溶液中加入稀硫酸并加热片刻再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
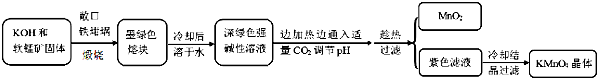
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
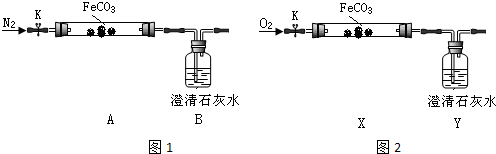
| 实验编号 | 实验步骤 | 实验现象 |
| i | 向甲溶液滴加KSCN溶液 | 溶液变红色 |
| ii | 向乙溶液滴加酸性高锰酸钾溶液 | 溶液不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用带玻璃塞的玻璃瓶盛放NaOH溶液 | |
| B. | SiO2和CO2都是酸性氧化物,既能与水反应,又能与NaOH溶液反应 | |
| C. | SiO2与纯碱在高温条件下反应生成CO2,说明硅酸的酸性比碳酸强 | |
| D. | 石灰石是工业制备普通玻璃和普通水泥的共同原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 左下方区域的金属元素 | B. | 金属和非金属分界线附近的元素 | ||
| C. | 过渡元素 | D. | 稀有气体元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
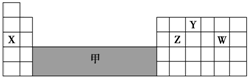
| A. | 可在灰色区域“甲”中寻找半导体材料 | |
| B. | X、Z、W 最高价氧化物对应的水化物之间两两能相互反应 | |
| C. | 气态氢化物的稳定性:Z<W | |
| D. | X只能形成一种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(B2)=0.8mol/(L•s) | B. | V(D)=0.6mol/(L•s) | ||
| C. | V(C)=0.6mol/(L•s) | D. | V(A2)=0.8mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com