
| A. | 碘化钾与氯气:5I-+3Cl2-+3H2O→IO3-+6Cl-+6H+ | |
| B. | KAl(SO4)2与Ba(OH)2:2Ba2++4OH-+Al3++2SO42-→2BaSO4↓+AlO2-+2H2O | |
| C. | 氨水与SO2:NH3•H2O+SO2→HSO3-+NH4+ | |
| D. | NaAlO2与AlCl3:Al3++3AlO2-+6H2O→4Al (OH)3↓ |
分析 A.氯气不足时,碘化钾与氯气反应生成碘单质,不会生成碘酸根离子;
B.氢氧化钡不足时,反应生成氢氧化铝沉淀,氢氧化钡过量时,反应生成偏铝酸根离子;
C.二氧化硫不足时,反应生成亚硫酸铵,二氧化硫过量时,反应生成亚硫酸氢铵;
D.无论偏铝酸根离子与铝离子的物质的量之比如何,反应都是生成氢氧化铝沉淀.
解答 解:A.碘化钾与氯气反应,氯气过量时为:5I-+3Cl2+3H2O═IO3-+6C1-+6H+,氯气不足时,碘离子被氧化成碘单质,氯气与碘化钾的物质的量之比影响不同,反应的离子方程式不同,故A错误;
B.Ba(OH)2过量时,反应的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,当Ba(OH)2不足时,反应生成氢氧化铝沉淀,所以反应物量的不同影响生成物,反应的离子方程式不同,故B错误;
C.氨水与SO2反应中,二氧化硫过量时,反应生成亚硫酸氢铵:NH3•H2O+SO2═HSO32-+NH4+,当二氧化硫不足时,反应生成SO32-离子,则反应物量的不同,反应方程式不同,故C错误;
D.NaAlO2与AlCl3的反应中,无论二者物质的量之比如何,反应的离子方程式都是:Al3++3AlO2-+6H2O4═Al(OH)3↓,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为中等难度的试题,注意掌握离子方程式的书写原则,正确判断反应物的过量确定对反应产物的影响为解答本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | FeCl3 Na2SO4 HCl | B. | NaOH NaCl HNO3 | ||
| C. | CuSO4 NaNO3 KOH | D. | Na2CO3 HCl Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/L的KHC2O4溶液中:c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-) | |
| B. | 25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合,溶液中离子浓度的关系:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 在0.1 mol/LNH4Cl溶液中:c(H+)=c(NH3•H2O)+c(OH-) | |
| D. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c (HClO)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
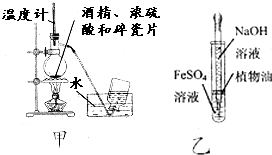
| A. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体 | |
| B. | 用甲图装置制取乙烯 | |
| C. | 用乙图装置制备少量氢氧化亚铁 | |
| D. | 加入适量乙醇和浓硫酸,加热,可除去乙酸乙酯中少量的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  配制一定物质的量浓度的稀硫酸 | B. | 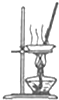 蒸发NH4Cl饱和溶液制备NH4Cl晶体 | ||
| C. | 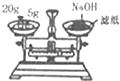 称量NaOH固体 | D. | 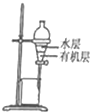 萃取后有机层从下口排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.铁的冶炼 | B.电池放电 | C.天然气燃烧 | D.碳酸氢钠做发酵粉 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水,可检验淀粉是否水解 | |
| B. | 做过碘升华的圆底烧瓶可以用酒精洗涤 | |
| C. | 为了验证Na2CO3固体中是否含有NaHCO3,溶于水后加石灰水,看有无沉淀 | |
| D. | 用pH试纸测定溶液pH时,通常是将pH试纸放入待测溶液中润湿后,半分钟内跟标准比色卡比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com