
| A. | Fe (OH )3 溶于稀 H 2 SO4 中:H++OH-→H2O | |
| B. | 氨水滴入 AlCl 3 溶液中:Al3++3OH-→Al(OH)3↓ | |
| C. | FeO 溶于稀 HCl 中:O2-+2H+→H2O | |
| D. | 铝溶解在 NaOH 溶液中:2Al+2OH-+2H2O→2AlO2-+3H2↑ |
分析 A.氢氧化铁为难溶物,离子方程式中不能拆开;
B.氨水为弱碱,离子方程式中一水合氨不能拆开;
C.氧化铁不能拆开,需要保留化学式;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和水.
解答 解:A.Fe(OH)3 溶于稀 H2SO4中,氢氧化铁不能拆开,正确的离子方程式为:3H++Fe(OH)3=Fe3++3H2O,故A错误;
B.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,一水合氨不能拆开,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.FeO溶于稀HCl中,FeO不能拆开,正确的离子方程式为:FeO+2H+=Fe2++H2O,故C错误;
D.铝溶解在 NaOH 溶液中,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
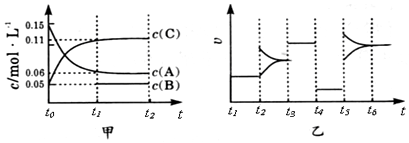
| A. | 该反应一定是放热反应 | B. | t4~t5阶段改变的条件为减小压强 | ||
| C. | B的起始物质的量为0.02mol | D. | 该反应的化学方程式为3A(g)+B(g)?2C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15mol 20% | B. | 20mol 20% | C. | 20mol 80% | D. | 40mol 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子电子层数增大 | |
| B. | 元素原子最外层电子数呈现周期性变化 | |
| C. | 元素的化合价呈现周期性变化 | |
| D. | 核电荷数依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种黄绿色的有毒气体 | |
| B. | 灼热的铜丝在氯气中燃烧,生成棕黄色的烟 | |
| C. | 可以用排饱和食盐水法收集氯气 | |
| D. | 氯水、液氯是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
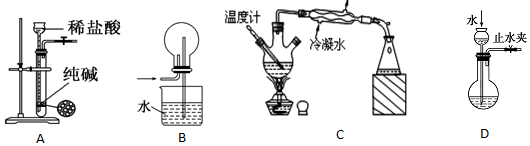
| A. | 用图A装置制取少量CO2气体 | |
| B. | 多余的NH3可用图B装置吸收 | |
| C. | 装置C可分离沸点不同且互溶的液体混合物 | |
| D. | 图D可检查装置的气密性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目减少 | ||
| C. | 该溶液的pH减小 | D. | 溶液的蓝色变浅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com