
【题目】药物F具有抗肿瘤、降血糖、降血压等多种生物活性,其合成路线如下:
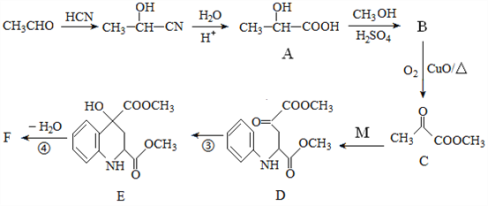
已知:M的结构简式为: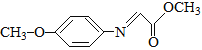 。
。
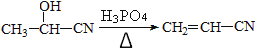
请回答下列问题:
(1)A的化学名称是_______________,③的反应类型是___________。
(2)C中官能团的名称是__________________________。
(3)写出F的结构简式__________________________。
(4)已知A在一定条件下能生成可降解的聚酯,请写出该反应化学方程式:_____________。
(5)满足下列条件的M的同分异构体有_______种(不含立体异构)。
①能够发生银镜反应。
②含有硝基(–NO2),且硝基直接连在苯环上。
③含有苯环且苯环上只有两个取代基。
其中核磁共振氢谱为四组峰且峰面积之比为6∶2∶2∶1的结构简式为________(写出一种即可)。
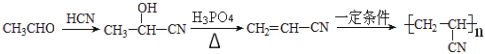
(6)写出用乙醛为原料制备高分子化合物聚丙烯腈的合成路线(无机试剂任选):____________
【答案】2-羟基丙酸(或α-羟基丙酸或乳酸) 加成反应 羰基(酮基),酯基 
![]() 15
15 
【解析】
(1)A属于羧酸,2号C原子中有1个羧基,故名称为2-羟基丙酸(或α-羟基丙酸或乳酸); 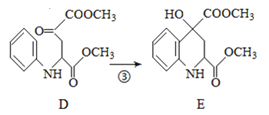 由D、E比较可得D中与酯基相连的羰基与氢气发生了加成反应生成E;
由D、E比较可得D中与酯基相连的羰基与氢气发生了加成反应生成E;
正确答案:2-羟基丙酸(或α-羟基丙酸或乳酸) ;加成反应。
(2)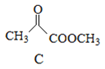 通过观察可知C的官能团为羰基(酮基),酯基;
通过观察可知C的官能团为羰基(酮基),酯基;
正确答案:羰基(酮基),酯基。
(3)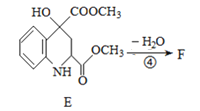 由于E到F失去水,考虑到醇的消去反应,所以得出F的结构简式
由于E到F失去水,考虑到醇的消去反应,所以得出F的结构简式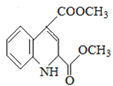 ;
;
正确答案: 。
。
(4)已知A在一定条件下能生成可降解的聚酯,该反应化学方程式:![]()
正确答案:![]()
(5)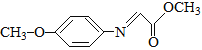 (M)的同分异构体满足①能够发生银镜反应,必有-CHO②含有硝基(–NO2),且硝基直接连在苯环上。③含有苯环且苯环上只有两个取代基。由以上条件确定官能团情况有五种:
(M)的同分异构体满足①能够发生银镜反应,必有-CHO②含有硝基(–NO2),且硝基直接连在苯环上。③含有苯环且苯环上只有两个取代基。由以上条件确定官能团情况有五种:
第一种:–NO2、–CH2 CH2 CH2CHO,第二种:–NO2、–CH(CH3)CH2CHO,第三种:–NO2、–CH2 CH(CH3)CHO,第四种:–NO2、–C(CH3)2CHO 第五种:–NO2、–CH(CH2CH3)CHO,五种情况中的两个取代基分别位于苯环的邻,间,对位,共3×5=15种;
其中核磁共振氢谱为四组峰且峰面积之比为6∶2∶2∶1的结构简式为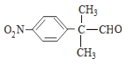 ;
;
正确答案:15、 。
。
(6)由信息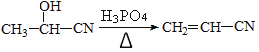 采用逆推法去思考同时注意观察题干中合成路线可得答案:
采用逆推法去思考同时注意观察题干中合成路线可得答案:![]()
正确答案:![]() 。
。


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2 为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32﹣ 的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列因果关系表述正确的是( )
A. 硅晶体具有半导体性能,可用于光导纤维
B. NH3易溶于水,可用作制冷剂
C. 铁比铜金属性强,可用FeCl3腐蚀Cu刻制印刷电路板
D. 氯水中的次氯酸具有氧化性,可用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量、浓度等)改变,不会引起产物改变的是 ( )
A. NaOH和CO2B. Fe粉在Cl2中燃烧
C. Na和O2D. Cu和HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用铜跟浓硫酸反应,探究SO2的部分性质,实验装置如图所示。
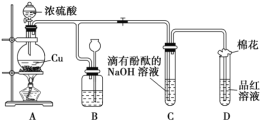
(1)装置A中发生的化学反应的化学方程式为________________________________。
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是________(填序号);
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有____________性。
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是____________。
(5)若实验中用一定质量的铜片和25.0 mL 18.0 mol·L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为d mol·L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾____________mol(用含d的代数式表示)。
(6)SO2气体为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
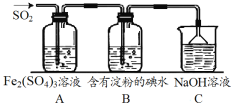
在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是_________,(填①或②)不合理的原因是____________。
(7)在上述装置中能表明SO2的还原性强于I2的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取 50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH 溶液,并用另一温度计测出其温度;③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入 NaOH 溶液的正确操作是_____(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与 NaOH 溶液混合均匀的正确操作是_____(填序号)。
A.用温度计小心搅拌 B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为 ΔH1、ΔH2、ΔH3,则 ΔH1、ΔH2、ΔH3 的大小关系为______________________。
(4)假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容 c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度 t1/ ℃ | 终止温度 t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热 ΔH=_____(结果保留一位小数)。_____(填“能”或“不能”)用 Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆 AB 两端分别挂有体积相同.质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入 M 的浓溶液,一段时间后, 下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )
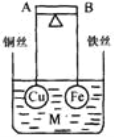
A. 当 M为盐酸、杠杆为导体时,A 端高,B 端低
B. 当 M为 AgNO3、杠杆为导体时,A 端高,B 端低
C. 当 M为 CuSO4、杠杆为导体时,A 端低,B 端高
D. 当 M为 CuSO4、杠杆为绝缘体时,A 端低,B 端高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com