
【题目】已知25 ℃时,醋酸溶液中存在下述关系:Ka=c(H+)c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中Ka的数值是该温度下醋酸的电离平衡常数。有关Ka的下列说法正确的是( )
A. 当向该溶液中加入一定量的硫酸时,Ka的值增大
B. 升高温度,Ka的值增大
C. 向醋酸溶液中加水,Ka的值增大
D. 向醋酸溶液中加氢氧化钠溶液,Ka的值增大
【答案】B
【解析】
醋酸溶液中存在CH3COOH ![]() H++CH3COO-, Ka=c(H+)c(CH3COO-)/c(CH3COOH),根据Ka的表达式和影响因素分析解答。
H++CH3COO-, Ka=c(H+)c(CH3COO-)/c(CH3COOH),根据Ka的表达式和影响因素分析解答。
A. 向醋酸溶液中加入一定量的硫酸时,c(H+)增大,CH3COOH ![]() H++CH3COO-平衡逆向移动,但温度不变,Ka不变,故A错误;
H++CH3COO-平衡逆向移动,但温度不变,Ka不变,故A错误;
B. 醋酸的电离为吸热过程,升高温度,促进电离,Ka的值增大,故B正确;
C. 向醋酸溶液中加水,促进醋酸的电离,但温度不变,Ka不变,故C错误;
D. 向醋酸溶液中加氢氧化钠溶液,c(H+)减小,CH3COOH ![]() H++CH3COO-平衡正向移动,但温度不变,Ka不变,故D错误;
H++CH3COO-平衡正向移动,但温度不变,Ka不变,故D错误;
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氮的化合物在工农业生产及航天航空业中具有广泛的用途。回答下列问题:
⑴NF3为无色、无味的气体,可用于微电子工业,该物质在潮湿的环境中易变质生成HF、NO、HNO3。该反应中氧化剂与还原剂的物质的量之比为______,NF3在空气中泄漏时很容易被观察到,原因是_______。
⑵汽车尾气中催化剂可将NO、CO转化成无害气体。
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能/kJ·mol1 | 1076 | 630 | 945 | 803 |
2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH
①ΔH=______________________________kJ·mol1。
②该反应的平衡常数与外界因素X(代表温度、压强、![]() 或催化剂接触面)关系如下图所示。
或催化剂接触面)关系如下图所示。
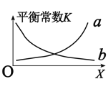
X是______,能正确表达平衡常数K随X变化的曲线是_______(填:a或b)。
⑶在一定温度和催化剂作用下,8NH3(g)+8NO(g)+2NO2(g)9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟时达到平衡时,c(NH3)=0.5mol·L1,c(NO2)=0.25mol·L1。
①n=_____;
②υ(NO)=______;
③NH3的平衡转化率为_________。
⑷用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将____________(填:增大、减小或不变)。阳极的电极反应式为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图某工厂用NO气体制取NH4NO3溶液,下列说法正确的是
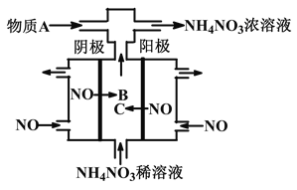
A. 阳极的电极反应式为:NO-3e-+2H2O=NO2-+4H+
B. 物质B与物质C是同一种物质
C. A物质可为氨气
D. 阴、阳两极转移的电子数之比为5∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿比朵尔是抗击新型冠状病毒的潜在用药,其结构简式如图示,下列有关说法正确的是
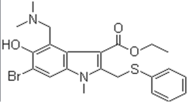
A.含氧官能团的名称:羟基、羧基
B.分子式:C22H25BrN2O3S
C.能使酸性高锰酸钾溶液、溴水褪色,且褪色原理相同
D.1mol该物质最多与6molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2催化加氢制甲醇,是极具前景的温室气体资源化研究领域。在某CO催化加氢制甲醇的反应体系中,发生的主要反应有:
i.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
ⅱ.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
ⅲ.CO(g)+2H2(g) ![]() CH3OH(g) △H3
CH3OH(g) △H3
(1)△H3________ kJ·mol-1
(2)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
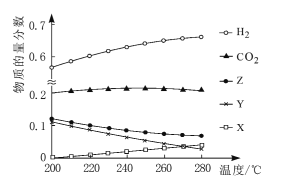
①体系中CO2的物质的量分数受温度的影响不大,原因是____。
②250℃时,反应ii的平衡常数____1(填“>”“<”或“=”)。
③下列措施中,无法提高甲醇产率的是____(填标号)。
A 加入适量CO B 增大压强 C 循环利用原料气 D 升高温度
④如图中X、Y分别代表____(填化学式)。
(3)反应i可能的反应历程如下图所示。
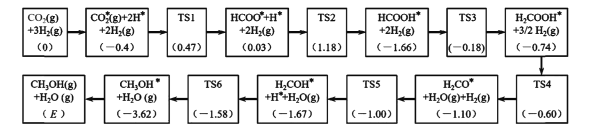
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV)。其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的决速步骤的反应方程式为____。
②相对总能量E=____(计算结果保留2位小数)。(已知:leV=1.6×10-22kJ)
(4)用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,往电解池的____极通入氢气,阴极上的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制0.40mol·L-1 Na2CO3溶液100mL。
⑴请将配制该溶液的实验步骤补充完整。
①计算,需Na2CO3固体的质量为__________g;
②把称量好的Na2CO3固体倒入小烧杯中,加入适量的蒸馏水溶解、冷却至室温;
③把②所得溶液小心引流到100mL容量瓶中;
④继续向容量瓶中加蒸馏水至液面接近容量瓶的刻度线1~2cm处,改用胶头滴管滴加蒸馏水至______________________________________________;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒_________次,并将每次洗涤的溶液都注入容量瓶,轻轻摇匀;
⑥将容量瓶的瓶塞盖好,反复上下颠倒、摇匀。
⑵容量瓶使用前需____________________________________。
⑶配制该溶液的正确顺序是______________________________(填序号)。
⑷若出现如下情况,其中将引起所配溶液浓度偏低的是__________(填序号)。
①未洗涤烧杯内壁和玻璃棒
②定容时,俯视容量瓶的刻度线
③转移前,容量瓶中含有少量蒸馏水
④加水定容时不慎超过了刻度线,再用胶头滴管吸出多余的液体
⑸上述配制好的溶液导入试剂瓶后需贴上标签,请你填写如图标签的内容_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2g铁粉投入200mL的稀硫酸中,充分反应后,铁粉完全溶解。(假设反应后溶液体积不发生变化,写出计算过程)
⑴求标准状况下产生气体的体积。(已知:Fe+H2SO4=FeSO4+H2↑)_____________
⑵求反应后溶液中FeSO4的物质的量浓度。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
已知:N2H4·H2O高温易分解,易氧化
制备原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
(实验一) 制备NaClO溶液(实验装置如图所示)
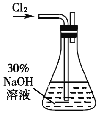
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有_____(填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是_____________________________。
(实验二) 制取水合肼。(实验装置如图所示)
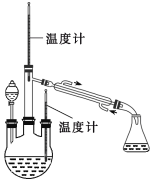
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114馏分。
(3)分液漏斗中的溶液是____________(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________。蒸馏时需要减压,原因是______________。
(实验三) 测定馏分中肼含量。
(4)水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体(保证滴定过程中溶液的pH保持在6.5左右),配制1000mL溶液。
b.移取10.00 mL于锥形瓶中,加入10mL水,摇匀。
c.用0.2000mol/L碘溶液滴定至溶液出现______________,记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(5)滴定时,碘的标准溶液盛放在______________滴定管中(选填:“酸式”或“碱式”)水合肼与碘溶液反应的化学方程式________________________。
(6)若本次滴定消耗碘的标准溶液为8.20mL,馏分中水合肼(N2H4·H2O)的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家已研制出一种可替代锂电池的“可充室温Na-CO2电池”,该电池结构如图所示。电极材料为钠金属片和碳纳米管,电解液为高氯酸钠-四甘醇二甲醚。下列说法错误的是( )
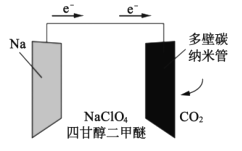
A.电池放电时钠金属片发生氧化反应
B.电池工作时,外电路流过0.01mol电子,负极材料减重0.23g
C.碳纳米管的作用主要是导电及吸附CO2,电池充电时,应该与直流电源的正极相连
D.放电时负极反应为:C+2Na2CO3-4e-=3CO2↑+4Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com