
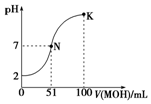
 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:分析 (1)根据0.01mol•L-1HA溶液的pH判断酸的强弱,溶液的pH2,说明完全电离;
(2)根据图示判断出MOH的碱性强弱,再判断MA稀溶液的酸碱性;盐溶液中水电离的氢氧根离子就等于溶液中的氢离子浓度;
(3)K点MOH的物质的量远远大于HA的物质的量,溶液显示碱性,据此进行比较离子浓度大小;
(4)根据溶液中的物料守恒进行判断浓度关系;根据溶液中的电荷守恒和物料守恒进行计算;
(5)根据MA的水解程度与MOH的电离程度相对大小判断.
解答 解:(1)根据图象知,加入碱溶液的体积为0时,0.01mol•L-1HA溶液的pH=2,氢离子浓度为0.01mol/L,氢离子浓度等于酸浓度,所以该酸在溶液中完全电离,属于强酸,
故答案为:强;0.01 mol•L-1HA的pH为2,说明HA完全电离;
(2)N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,MA属于强酸弱碱盐,水解显示酸性,即a<7;水电离的氢氧根离子等于溶液中氢离子的浓度,即c(OH-)=1×10-amol•L-1,
故答案为:<;1×10-amol•L-1;
(3)由于在K点,MOH的物质的量远远大于HA的物质的量,溶液显示碱性,所以溶液中浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+),
故答案为:c(M+)>c(A-)>c(OH-)>c(H+);
(4)K点时,加入的MOH的物质的量=0.02mol•L-1×0.1L=0.002mol,混合溶液的体积是0.2L,根据物料守恒知,c(M+)+c(MOH)=$\frac{0.002mol}{0.2L}$=0.01mol/L,
HA是强酸,所以反应后的溶液中,c(A-)=$\frac{1}{2}$×0.01mol•L-1=0.005mol•L-1,故c(M+)+c(MOH)=2c(A-);
根据电荷守恒可得:c(H+)+c(M+)=c(A-)+c(OH-),
由c(M+)+c(MOH)=0.01mol/L,可得c(M+)=0.01mol/L-c(MOH),带入电荷守恒公式可得:c(H+)+0.01mol/L-c(MOH)=c(A-)+c(OH-),
整理可得:c(MOH)+c(OH-)=c(H+)+0.01mol/L-c(A-)=10-10mol/L+0.01mol/L-0.005mol•L-1=0.005+1×10-10mol•L-1,
故答案为:=;0.005+1×10-10.
(5)K点溶液为等浓度的MA和MOH,MOH电离显碱性,MA水解显酸性,MOH的电离程度大于MA的水解程度,使溶液呈碱性;
故答案为:K点为等浓度的MA和MOH的混合溶液,MOH的电离程度大于MA的水解程度,使溶液呈碱性.
点评 本题考查了弱电解质的电离、盐类的水解、溶液的稀释、离子浓度的大小比较等知识点,题目难度中等,注意掌握盐的水解原理及其应用方法,能够利用电荷守恒、物料守恒判断溶液中离子浓度大小.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+2H2S═S+2H2O | B. | 2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑ | ||
| C. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | D. | 3Cl2+6KOH═5KCl+KClO3+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下分别测等体积、等浓度的醋酸和氨水pH,发现二者的pH 之和为14,说明常温下醋酸和氨水的电离平衡常数相等 | |
| B. | 将CH3COONa溶液从25℃升温至 40℃,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| C. | 向硝酸中加入氨水至中性,溶液中$\frac{{c(N{H_4}^+)}}{{c(N{O_3}^-)}}$<1 | |
| D. | 向AgCl、AgBr 的饱和溶液中加入少量 AgNO3,溶液中$\frac{c(C{l}^{-})}{c(B{r}^{-})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com