
| A. | 0.50mol•L-1 H2SO4溶液 | B. | 0.50mol•L-1 KNO3 溶液 | ||
| C. | 0.50mol•L-1酒精溶液 | D. | 0.50mol•L-1NaOH溶液 |
科目:高中化学 来源: 题型:解答题
 ,不考虑立体异构)是临床上使用广泛的.下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的.下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)

 .
. .
.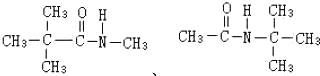 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| C. | FeCl3溶液:K+、Na+、SO42-、AlO2- | |
| D. | 含0.1mol/LNH4Al(SO4)2的溶液:K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Cl2 | C. | KClO3 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
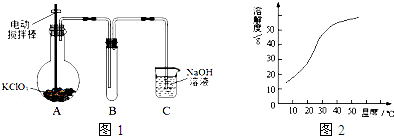
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com