
 £Ø1£©ŅŃÖŖH-H ¼üÄÜĪŖ436kJ•mol-1£¬H-N¼ü¼üÄÜĪŖ391kJ•mol-1£¬øł¾Ż»Æѧ·½³ĢŹ½£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-92.4kJ•mol-1£®ŌņN”ŌN¼üµÄ¼üÄÜŹĒ945.6kJ•mol-1
£Ø1£©ŅŃÖŖH-H ¼üÄÜĪŖ436kJ•mol-1£¬H-N¼ü¼üÄÜĪŖ391kJ•mol-1£¬øł¾Ż»Æѧ·½³ĢŹ½£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©”÷H=-92.4kJ•mol-1£®ŌņN”ŌN¼üµÄ¼üÄÜŹĒ945.6kJ•mol-1·ÖĪö £Ø1£©øł¾Ż·“Ó¦ČČ”÷H=·“Ó¦ĪļµÄ×ܼüÄÜ-Éś³ÉĪļµÄ×ܼüÄÜ£¬¾Ż“Ė¼ĘĖć£»
£Ø2£©Äܹ»Éč¼Ę³ÉŌµē³ŲµÄ·“Ó¦»¹±ŲŠėŹĒ×Ō·¢µÄŃõ»Æ»¹Ō·“Ó¦£»
£Ø3£©ĒāŃõČ¼ĮĻµē³ŲÖŠŃõĘųŌŚÕż¼«ÉĻ·“Ó¦£»
£Ø4£©¢ŁČōµē½āĮņĖįĶČÜŅŗŹ±£¬Ńō¼«ÉĻĒāŃõøłĄė×ӷŵē£¬Ņõ¼«ÉĻĶĄė×ӷŵē£¬¾Ż“ĖŠ“³öµē³Ų·“Ó¦Ź½£»
¢Śøł¾Ż×ŖŅʵē×ÓŹŲŗć¼ĘĖćŅõ¼«ÉĻĪö³öµÄĪļÖŹ£¬ŌŁøł¾ŻŃõĘų¼ĘĖćÉś³ÉµÄC£ØH+£©£¬“Ó¶ųµĆ³öĘäpH£»
¢Ū¹¤Ņµ¾«Į¶ĶŹ±£¬Ńō¼«ŹĒ“ÖĶ£¬µē½āŅŗĪŖŗ¬ĶĄė×ÓµÄČÜŅŗ£®
½ā“š ½ā£ŗ£Ø1£©ŅŃÖŖ£ŗH-H¼üÄÜĪŖ436kJ•mol-1£¬N-H¼ü¼üÄÜĪŖ391kJ•mol-1£¬ĮīN”ŌNµÄ¼üÄÜĪŖx£¬
¶ŌÓŚ·“Ó¦N2£Øg£©+3H2£Øg£©ØT2NH3£Øg£©”÷H=-92.4kJ•mol-1£®
·“Ó¦ČČ”÷H=·“Ó¦ĪļµÄ×ܼüÄÜ-Éś³ÉĪļµÄ×ܼüÄÜ£¬¹Źx+3”Į436kJ•mol-1-2”Į3”Į391kJ•mol-1=-92.4kJ•mol-1£¬½āµĆ£ŗx=945.6kJ•mol-1£¬
¹Ź“š°øĪŖ£ŗ945.6kJ•mol-1£»
£Ø2£©Äܹ»Éč¼Ę³ÉŌµē³ŲµÄ·“Ó¦»¹±ŲŠėŹĒ·ÅČȵÄŃõ»Æ»¹Ō·“Ó¦£¬
¹Ź“š°øĪŖ£ŗB£»
£Ø3£©ŅŌKOHČÜŅŗĪŖµē½āÖŹČÜŅŗ£¬ĒāŃõČ¼ĮĻµē³ŲÖŠŃõĘųŌŚÕż¼«ÉĻ·“Ӧɜ³ÉĒāŃõøłĄė×Ó£¬µē¼«·“Ó¦Ź½ĪŖO2+4e-+2H2O=4OH-£¬
¹Ź“š°øĪŖ£ŗO2+4e-+2H2O=4OH-£»
£Ø4£©¢Łµē½āĮņĖįĶČÜŅŗŹ±£¬Ńō¼«ÉĻÉś³ÉŃõĘų£¬Ņõ¼«ÉĻÉś³ÉĶ£¬Ķ¬Ź±ČÜŅŗÖŠÉś³ÉĮņĖį£¬ĖłŅŌµē³Ų·“Ó¦Ź½ĪŖ£ŗ2CuSO4+2H2O $\frac{\underline{\;µē½ā\;}}{\;}$2Cu+O2”ü+2H2SO4£¬
¹Ź“š°øĪŖ£ŗ2CuSO4+2H2O $\frac{\underline{\;µē½ā\;}}{\;}$2Cu+O2”ü+2H2SO4£»
¢Śµē½āŗ¬ÓŠ0.04molCuSO4ŗĶ0.04molNaClµÄ»ģŗĻČÜŅŗ400ml£¬Ńō¼«ÉĻĻČÉś³ÉĀČĘųŗóÉś³ÉŃõĘų£¬Ņõ¼«ÉĻĻČÉś³ÉĶ£¬ŗóÉś³ÉĒāĘų£¬Ńō¼«ÉĻĀČĘųĶźČ«Īö³öŹ±£¬ĀČĘųµÄĢå»ż=$\frac{0.04mol}{2}$”Į22.4L/mol=448mL£¼672mL£¬ĖłŅŌŃō¼«ÉĻ»¹ÓŠ224mLŃõĘų£¬Ńō¼«ÉĻ×ŖŅʵē×ÓµÄĪļÖŹµÄĮæ=0.04mol”Į1+$\frac{0.224L}{22.4L/mol}$”Į4=0.08mol£¬Ņõ¼«ÉĻĶĶźČ«Īö³öŹ±£¬ŠčŅŖµē×ÓµÄĪļÖŹµÄĮæ=0.04mol”Į2=0.08mol£¬ĖłŅŌŅõ¼«ÉĻ²»Īö³öĒāĘų£¬Éś³É224mLŃõĘųŹ±£¬Ńō¼«ø½½üĶ¬Ź±Éś³Éc£ØH+£©=£Ø$\frac{0.224L}{22.4L/mol}$”Į4£©”Ā0.4L=0.1mol/L£¬ĖłŅŌČÜŅŗµÄpH=1£¬
¹Ź“š°øĪŖ£ŗ1£»
¢Ū¹¤Ņµ¾«Į¶ĶŹ±£¬Ńō¼«ŹĒ“ÖĶ£¬µē½āŅŗĪŖŗ¬ĶĄė×ÓµÄČÜŅŗCuSO4»ņCuCl2£¬
¹Ź“š°øĪŖ£ŗCuSO4»ņCuCl2£®
µćĘĄ ±¾Ģā漲鹹³ÉŌµē³ŲµÄĢõ¼ž”¢µē½ā³ŲµÄÓŠ¹Ų¼ĘĖćµČÖŖŹ¶µć£¬ÄѵćŹĒ£Ø4£©ÖŠČÜŅŗpHµÄ¼ĘĖć£¬Ö»ÓŠĆ÷Č·ŅõŃō¼«ÉĻĪö³öµÄĪļÖŹ²ÅÄÜÕżČ·½ā“š£¬ĪŖŅדķµć£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
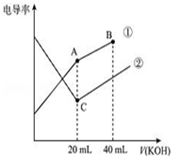 µēµ¼ĀŹŹĒŗāĮæµē½āÖŹČÜŅŗµ¼µēÄÜĮ¦“󊔵ÄĪļĄķĮ棬¾ŻČÜŅŗµēµ¼ĀŹ±ä»ÆæÉŅŌČ·¶ØµĪ¶Ø·“Ó¦µÄÖÕµć£®ČēĶ¼ŹĒijĶ¬Ń§ÓĆ0.1mol/L KOHČÜŅŗ·Ö±šµĪ¶ØĢå»ż¾łĪŖ20mL”¢ÅØ¶Č¾łĪŖ0.1mol/LµÄHClŗĶCH3COOHČÜŅŗµĪ¶ØĒśĻߏ¾ŅāĶ¼£Ø»ģŗĻČÜŅŗĢå»ż±ä»ÆŗöĀŌ²»¼Ę£©£®ĻĀĮŠÓŠ¹ŲÅŠ¶Ļ²»ÕżČ·µÄŹĒ£Ø””””£©
µēµ¼ĀŹŹĒŗāĮæµē½āÖŹČÜŅŗµ¼µēÄÜĮ¦“󊔵ÄĪļĄķĮ棬¾ŻČÜŅŗµēµ¼ĀŹ±ä»ÆæÉŅŌČ·¶ØµĪ¶Ø·“Ó¦µÄÖÕµć£®ČēĶ¼ŹĒijĶ¬Ń§ÓĆ0.1mol/L KOHČÜŅŗ·Ö±šµĪ¶ØĢå»ż¾łĪŖ20mL”¢ÅØ¶Č¾łĪŖ0.1mol/LµÄHClŗĶCH3COOHČÜŅŗµĪ¶ØĒśĻߏ¾ŅāĶ¼£Ø»ģŗĻČÜŅŗĢå»ż±ä»ÆŗöĀŌ²»¼Ę£©£®ĻĀĮŠÓŠ¹ŲÅŠ¶Ļ²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ĒśĻߢŁ“ś±ķ0.1 mol/L KOHČÜŅŗµĪ¶ØCH3COOHČÜŅŗµÄµĪ¶ØĒśĻߣ¬ĒśĻߢŚ“ś±ķ0.1 mol/L KOHČÜŅŗµĪ¶ØHClČÜŅŗµÄµĪ¶ØĒśĻß | |
| B£® | ŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬CµćĖ®µēĄėµÄc£ØH+£©Š”ÓŚAµćĖ®µēĄėµÄ c£ØH+£© | |
| C£® | ŌŚAµćµÄČÜŅŗÖŠÓŠ£ŗc£ØCH3COO-£©+c£ØOH-£©-c£ØH+£©=0.1 mol/L | |
| D£® | ŌŚBµćµÄČÜŅŗÖŠÓŠ£ŗc£ØK+£©£¾c£ØOH-£©£¾c£ØCH3COO-£©£¾c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
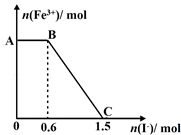 ŅŃÖŖĖįŠŌK2Cr2O7ČÜŅŗæÉÓėFeSO4·“Ӧɜ³ÉFe3+ŗĶCr3+£¬ĻÖ½«ĮņĖįĖį»ÆµÄK2Cr2O7ČÜŅŗÓėFeSO4ČÜŅŗ»ģŗĻ£¬³ä·Ö·“Ó¦ŗóŌŁĻņĖłµĆČÜŅŗÖŠ¼ÓČėKIČÜŅŗ£¬»ģŗĻČÜŅŗÖŠFe3+µÄĪļÖŹµÄĮæĖę¼ÓČėµÄKIµÄĪļÖŹµÄĮæµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£Ø””””£©
ŅŃÖŖĖįŠŌK2Cr2O7ČÜŅŗæÉÓėFeSO4·“Ӧɜ³ÉFe3+ŗĶCr3+£¬ĻÖ½«ĮņĖįĖį»ÆµÄK2Cr2O7ČÜŅŗÓėFeSO4ČÜŅŗ»ģŗĻ£¬³ä·Ö·“Ó¦ŗóŌŁĻņĖłµĆČÜŅŗÖŠ¼ÓČėKIČÜŅŗ£¬»ģŗĻČÜŅŗÖŠFe3+µÄĪļÖŹµÄĮæĖę¼ÓČėµÄKIµÄĪļÖŹµÄĮæµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | Ķ¼ÖŠAB¶ĪµÄŃõ»Æ¼ĮĪŖK2Cr2O7 | |
| B£® | Ķ¼ÖŠBC¶Ī·¢ÉśµÄ·“Ó¦ĪŖ2Fe3++2I-ØT2Fe2++I2 | |
| C£® | æŖŹ¼¼ÓČėµÄK2Cr2O7ĪŖ0.25 mol | |
| D£® | ¹²ÓŠ1molFeSO4±»Ńõ»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
 £¬ĖüæÉĶعż²»Ķ¬»Æѧ·“Ó¦·Ö±šÖʵĆB”¢C”¢DŗĶEĖÄÖÖĪļÖŹ£®
£¬ĖüæÉĶعż²»Ķ¬»Æѧ·“Ó¦·Ö±šÖʵĆB”¢C”¢DŗĶEĖÄÖÖĪļÖŹ£®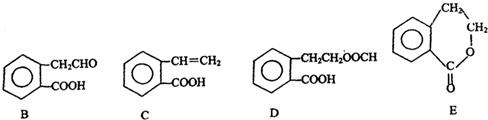
 £®
£® £®
£®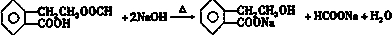 £®
£®²éæ““š°øŗĶ½āĪö>>
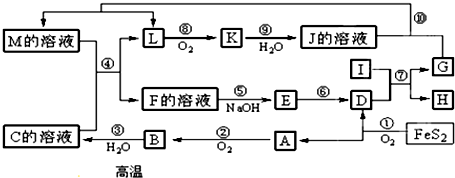
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
| Ę·Ćū | ÅØĖõ³ČÖ |
| ÅäĮĻ | Ė®”¢ĢĒ”¢ĻŹ³ČÅØĖõŅŗ”¢ÄūĆŹĖį”¢Ī¬ÉśĖŲC”¢¦Ā-ŗśĀܲ·ĖŲ”¢É½ĄęĖį¼ŲµČ |
| ĻŹ³ČŌÖŗ¬Įæ | ”Ż20% |
| ¾»ŗ¬Įæ | 1.5L |
| Éś²śČÕĘŚ | ±źÓŚĘæøĒÉĻ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CH2ØTCH2+Cl2”śCH2ClCH2Cl | B£® | 2CH3CH2OH+O2$”ś_{”÷}^{Cu}$2CH3CHO+2H2O | ||
| C£® | 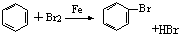 | D£® | 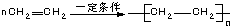 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Al3+”¢NH4+”¢Cl-”¢SO42- | B£® | Na+”¢Cl-”¢SO42-”¢HCO3- | ||
| C£® | Na+”¢CH3COO-”¢NO3-”¢K+ | D£® | K+”¢Na+”¢Cl-”¢SO42- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com