
| A. | 室温下,0.001 mol•L-1的醋酸中由水电离的c(H+)=10-11mol•L-1 | |
| B. | Na2CO3溶液中存在c(Na+)+c(H+)═c(OH-)+a c(X)+b c(Y),若X为HCO3-,则b=2 | |
| C. | 某温度下,浓度均为0.01mol•L-1的盐酸和氢氧化钠溶液的pH分别为2和12 | |
| D. | 向0.1mol•L-1氯化铵溶液滴加几滴浓盐酸,c(NH4+)减小,PH增大 |
分析 A.醋酸为弱酸部分电离;
B.根据电荷守恒分析;
C.温度不知道,则Kw的数据不知,无法计算NaOH溶液的pH;
D.加浓盐酸,氢离子浓度增大.
解答 解:A.醋酸为弱酸部分电离,醋酸中氢离子浓度小于0.001 mol•L-1,则氢氧根离子的浓度大于10-11mol•L-1,所以c(H+)>10-11mol•L-1,故A错误;
B.Na2CO3溶液中存在电荷守恒:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2 c(CO32-),若X为HCO3-,则b=2,故B正确;
C.温度不知道,则Kw的数据不知,氢氧化钠溶液中c(H+)=$\frac{Kw}{c(O{H}^{-})}$,所以无法计算NaOH溶液的pH,故C错误;
D.向0.1mol•L-1氯化铵溶液滴加几滴浓盐酸,抑制铵根离子的水解,则c(NH4+)增大,加浓盐酸,氢离子浓度增大,pH减小,故D错误.
故选B.
点评 本题考查了盐的水解、溶液中离子浓度的计算,题目难度不大,注意酸、碱、盐溶液中氢离子和氢氧根离子的计算方法.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LSO3所含电子数约为40 NA | |
| B. | 0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA | |
| C. | 92 g NO2、N2O4混合气体含有的N原子数为2NA | |
| D. | 1 mol Cl2作为氧化剂得到的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、C、P、S分别在足量氧气中燃烧均生成一种相应氧化物:Na2O2、CO2、P2O5、SO3 | |
| B. | 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳,浓硝酸、浓疏酸都能使铁、铝钝化 | |
| C. | 欲鉴别NO2、Br2(g)两种红棕色气体,将两种待测气体分別通入AgNO3溶液中 | |
| D. | 将久置于空气中的Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变为红色,说 明Fe(NO3)2样品在空气中已变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯 | |
| B. | 棉花、羊毛、蚕丝和麻等是天然纤维 | |
| C. | 高聚物 中的官能团是酯基 中的官能团是酯基 | |
| D. | 可以用溴水鉴别乙醛和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
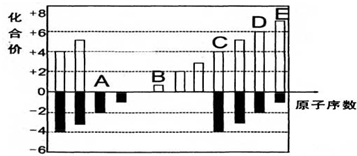
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该栀子酯的分子式C10H11O2 | |
| B. | 1mol栀子酯水解需要消耗2mol NaOH | |
| C. | 栀子酯可以发生加成、取代和消去反应 | |
| D. | 栀子酯的一氯代物有六种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |

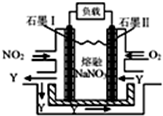
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
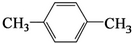
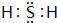 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
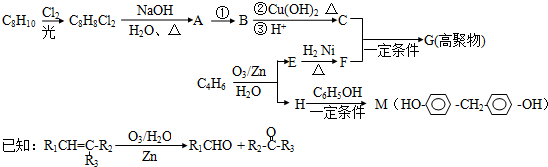
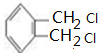
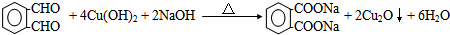
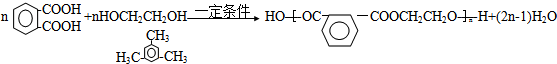
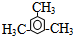 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com