

分析 (1)在空气中煅烧Ce(OH)CO3可制备CeO2,结合质量守恒定律书写化学方程式;
(2)电解熔融状态的CeO2可制备Ce,在阴极获得铈,阴极是Ce4+离子得到电子生成Ce;
(2)废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入氧化剂C可生成硫酸铁,所加氧化剂应避免引入新杂质,滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4;
①固体表面可吸附Fe3+、Fe2+;
②CeO2与H2O2反应生成Ce2(SO4)3和O2;
③根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶;
④依据滴定过程反应的定量关系计算Ce(OH)4质量分数,FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大,测定该Ce(OH)4产品的质量分数会增大.
解答 解:(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应方程式为4Ge(OH)CO3+O2═4GeO2+4CO2+2H2O,
故答案为:4 Ce(OH)CO3+O2=4CeO2+4CO2+2H2O;
(2)电解熔融状态的CeO2可制备Ce,在阴极获得铈,阴极是Ce4+离子得到电子生成Ce,电极反应为:Ce4++4e-=Ce,故答案为:Ce4++4e-=Ce;
(3)废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入氧化剂C可生成硫酸铁,所加氧化剂应避免引入新杂质,滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4,
①滤渣A的成分是Fe2O3、CeO2、FeO,与硫酸反应后溶液中存在Fe3+、Fe2+,固体表面可吸附Fe3+、Fe2+,检验滤渣B已经洗涤干净的方法是取最后一次的洗涤液滴入KSCN溶液无变化,加入氯水若不变红色,证明洗涤干净,
故答案为:取最后一次的洗涤液滴入KSCN溶液无变化,加入氯水若不变红色,证明洗涤干净;
②CeO2与H2O2反应生成Ce2(SO4)3和O2,反应的方程式为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,离子方程式为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,
故答案为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
③根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶,故答案为:冷却结晶;
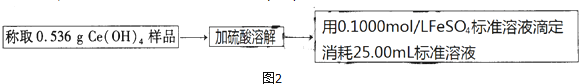
④称取0.536g样品,加入硫酸溶解,用0.1000mol/LFeSO4溶液滴定,消耗25.00ml溶液,
Ce4++Fe2+=Fe3++Ce3+,
依据元素守恒计算n(Ce(OH)4)=n(Fe2+)=0.1000mol/L×0.0250L=2.5×10-3mol,含量=$\frac{2.5×1{0}^{-3}mol×208g/mol}{0.536g}$×100%=97.10%,
FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大,测定该Ce(OH)4产品的质量分数会偏高,
故答案为:97.10%;偏高.
点评 本题以工艺流程为基础,考查了化学实验基本操作、元素及化合物知识反应等相关知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该反应中的还原剂是C、氧化剂是S和KNO3 | |
| B. | 能做炸药的原因之一是固体物质反应生成了大量的气体 | |
| C. | 由此反应可推出S的氧化性强于N2 | |
| D. | 当生成标准状况下4.48L气体时,共转移电子0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁有剩余 | |
| B. | 往溶液中滴入无色KSCN溶液,显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物与还原产物的物质的量之比为2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl.
(1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl. | H- | Cl- | I- | |
| -H | H-H | H-Cl | H-I |
| -Cl | H-Cl | Cl-Cl | |
| -I | H-I | I-I |
| 反应物 | 化合物(A) | Br2 |
| Na | 2Na+Br2=2NaBr | |
| H2 | H2+Br2=2HBr | |
| H2O | H2O+Br2?HBr+HBrO | |
| Kl | 2Kl+Br2=I2+2KBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com