
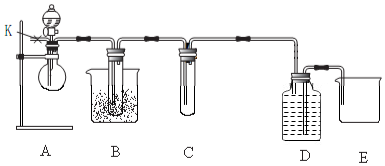
分析 探究铁与浓度为1.15mol/L~1.25mol/L的硝酸反应可同时得到NO2、NO、N2三种气体,若二氧化氮气体,NO2沸点为21.1℃,经过冰盐水冷却生成的气体,出现红棕色液体,C中盛放酸性高锰酸钾,若出现高锰酸钾褪色,说明有NO生成,氧化反应为:5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O,最后采用排水法测定剩余的氮气,
(1)根据空气中含氮气和氧气及NO遇空气中的氧气就反应生成NO2分析;根据得失电子守恒计算消耗铁的质量;
(2)根据以上分析,二氧化氮为红棕色气体,冰盐水冷却生成的气体,出现有色液体;
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,为NO和高锰酸根离子反应氧化还原反应,根据质量守恒和得失电子守恒配平;
(4)将等物质的量的NO2、NO混合后通入低温下的水中发生价态归中反应生成亚硝酸;比较X的酸性与亚硫酸的酸性的相对强弱,利用强酸制弱酸的原理.
解答 解:(1)根据实验原理检验铁与浓度为1.15mol/L~1.25mol/L的硝酸反应时可同时得到NO2、NO、N2三种气体,又空气中含氮气和氧气及NO遇空气中的氧气就反应生成NO2,所以装置中的空气对生成的NO、N2的检验产生干扰,则实验时先通过K处导管向装置内通入CO2气体以排除装置内空气;
若生成上述三种还原产物各0.02mol,根据得失电子守恒,则需要消耗铁的质量(硝酸足量)为$\frac{0.02×(5-4)+0.02(5-2)+0.02×(5-0)×2}{3}$×56=5.23g;
故答案为:防止氧气、氮气对生成的NO、N2的检验产生干扰;5.23;
(2)根据以上分析,二氧化氮为红棕色气体,冰盐水冷却NO2,使其液化,出现有色液体,所以证明有NO2生成的现象是B中试管有红棕色液体出现;
故答案为:冷却NO2,使其液化;B中试管有红棕色液体出现;
(3)C中溶液颜色慢慢褪去,为NO和高锰酸根离子反应氧化还原反应,该反应中,反应中物质的化合价变化:MnO4-→Mn2+,Mn元素化合价由+7价→+2价,一个MnO4-得5个电子;NO→NO3-,N由+2价变成+5价,一个NO分子失去3个电子,所以其最小公倍数为15,故MnO4-的计量数为3,NO的计量数为5,然后根据原子守恒配平其它元素,配平后的离子方程式为:5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O,
故答案为:5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O;
(4)将等物质的量的NO2、NO混合后通入低温下的水中发生价态归中反应,反应方程式为:NO2+NO+H2O=2HNO2,所以X的化学式为HNO2;
比较X的酸性与亚硫酸的酸性的相对强弱,利用强酸制弱酸的原理,又HNO2具有氧化性,而Na2SO3溶液具有强还原性,所以两者发生氧化还原反应,没有发生
强酸制弱酸的反应;
故答案为:HNO2;HNO2能氧化SO32-.
点评 本题考查性质方案的设计,题目难度中等,涉及反应产物的测定、对实验原理与装置的理解、实验方案设计等知识,题理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
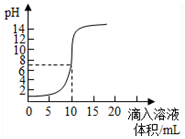
| A. | 原来盐酸的物质的量浓度为0.1mol•L-1 | |
| B. | 可以选择红色石蕊作为指示剂 | |
| C. | 氢氧化钠的物质的量浓度为0.1mol•L-1 | |
| D. | pH为7时加入的氢氧化钠的物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.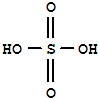 )溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯(
)溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯( )和硫酸二乙酯(
)和硫酸二乙酯(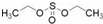 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 颜色状态 | 密度/g/cm3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸* | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
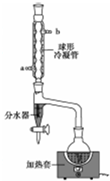 乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物.实验室用正丁醇和乙酸制备,反应原理如下:
乙酸正丁酯是一种水果香味的无色透明液体,常用于调制香料和药物.实验室用正丁醇和乙酸制备,反应原理如下:| 物质名称 | 沸点/℃ | 熔点/℃ | 密度/g•cm-3 | 水中溶解度 |
| 正丁醇 | 117.3 | -89.5 | 0.80 | 7.1g/100g |
| 乙酸 | 118 | 16.6 | 1.0492 | 互溶 |
| 乙酸正丁酯 | 126.1 | -78 | 0.8826 | 1.4g/100g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水蒸气通过灼热的铁粉生成氢氧化铁和氢气 | |
| B. | Mg比Al活泼,更易与NaOH溶液反应生成H2 | |
| C. | Na在空气中长期放置最终变为Na2CO3粉末 | |
| D. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com