
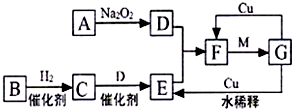
 ��ͼ���ɶ�����Ԫ����ɵ�һЩ���ʼ��仯����֮���ת����ϵͼ��ijЩ��Ӧ������������������ȥ��������A��B��D�ڳ����¾�Ϊ��ɫ�̼�����ζ�����壬M���������ɫҺ�壮
��ͼ���ɶ�����Ԫ����ɵ�һЩ���ʼ��仯����֮���ת����ϵͼ��ijЩ��Ӧ������������������ȥ��������A��B��D�ڳ����¾�Ϊ��ɫ�̼�����ζ�����壬M���������ɫҺ�壮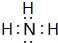 ��
������ ��ɫ��ζ����A��������Ʒ�Ӧ�õ���ɫ��ζ����D����֪AΪCO2��DΪO2��M���������ɫҺ�壬ӦΪH2O����ɫ��ζ����B��������Ӧ�õ�C��C����������������Ӧ����F��������Ԫ�ص��ʻ��������ת����ϵ��F��ˮ��Ӧ�õ�GΪ�ᣬ�Ҳ�ͬŨ�ȵ�G��Cu��Ӧ������֪BΪN2��CΪNH3��EΪNO��FΪNO2��GΪHNO3��
��� �⣺��ɫ��ζ����A��������Ʒ�Ӧ�õ���ɫ��ζ����D����֪AΪCO2��DΪO2��M���������ɫҺ�壬ӦΪH2O����ɫ��ζ����B��������Ӧ�õ�C��C����������������Ӧ����F��������Ԫ�ص��ʻ��������ת����ϵ��F��ˮ��Ӧ�õ�GΪ�ᣬ�Ҳ�ͬŨ�ȵ�G��Cu��Ӧ������֪BΪN2��CΪNH3��EΪNO��FΪNO2��GΪHNO3��
��1������G�Ļ�ѧʽ��HNO3��
�ʴ�Ϊ��HNO3��
��2������BΪNH3������ʽ��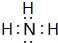 ��
��
�ʴ�Ϊ��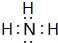 ��
��
��3����ӦG��E�����ӷ���ʽ��3Cu+8H++2NO3-=3Cu2++2NO+4H2O��
�ʴ�Ϊ��3Cu+8H++2NO3-=3Cu2++2NO+4H2O��
��4��n��Cu��=$\frac{2.88g}{64g/mol}$=0.045mol��n��H+��=0.2mol/L��0.25L+0.1mol/L��2��0.25L=0.1mol��n��NO3-��=0.2mol/L��0.25L=0.05mol��
3 Cu+8 H++2 NO3-=3Cu2++2NO��+4H2O
3 8 2
0.0375mol 0.1mol 0.025mol
��ȻH+���㣬��ȫ��Ӧ����ͭ����0.1mol��$\frac{3}{8}$=0.0375mol��
������Һ��c��Cu2+��=$\frac{0.0375mol}{0.25L}$=0.15mol/L��
�ʴ�Ϊ��0.15mol/L��
���� ���⿼�������ƶϣ�A��������Ʒ�Ӧ����D��C��������������Ӧ�Լ�G��Cu�ķ�Ӧ�����ƶ�ͻ�ƿڣ���������Ԫ�ػ��������ʣ���4����ע���������ӷ���ʽ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˮ�ڽ��ʱ������ͣ�������ˮ����֮�������� | |
| B�� | NH3���ȶ��Ժ�ǿ������Ϊ����Ӽ����γ���� | |
| C�� | �ڰ�ˮ��ˮ���ӺͰ�����֮��Ҳ��������� | |
| D�� | ���Ӽ��������������ƻ��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Al2��S04��3��Һ�м��������ˮ��Al3++4NH3��H2O=AlO2-+4NH4++2H2O | |
| B�� | ����ʯ��ˮ������С�մ���Һ��ϣ�Ca2++2OH-+2HCO3-=CaCO3��+2H2O+CO32- | |
| C�� | ��������������ϡ���3Fe2++4H++N03-=3Fe3++NO��+2H2O | |
| D�� | ����п�̵��������Ӧ��2MnO2+2H2O+2eһ=2MnOOH+2OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ǿ����HIO4��HBrO4��HClO4 | B�� | ԭ�Ӱ뾶��С��Na��O��S | ||
| C�� | ����ǿ����KOH��NaOH��LiOH | D�� | ������ǿ����Na��Mg��Al |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D | |
| ��Ʒ���� | ú̿  | ��ȩ��֬�ֱ� | ����  | �ֹ�����  |
| ��Ҫ�ɷ� | C ̼���� | 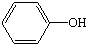 ���� | Al2��SO4��3•12H2O ʮ��ˮ�������� | C17H35COONa Ӳ֬���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
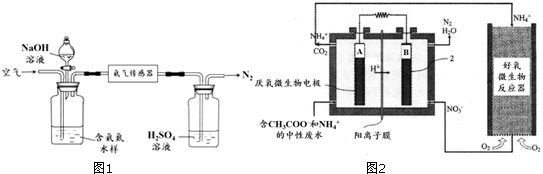
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
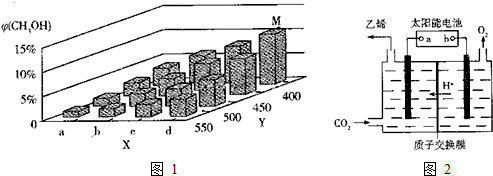
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
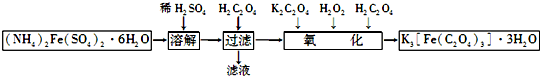
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com