
| A. | Fe2+、Fe3+、Cu2+ | B. | Fe2+、Cu2+、Fe3+ | C. | Cu2+、Fe2+、Fe3+ | D. | Fe3+、Cu2+、Fe2+ |
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 分别配成1mol/L的溶液,各取1mL滴加1滴酚酞试液,比较颜色深浅 | |
| B. | 分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊 | |
| C. | 分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| D. | 分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸保存在无色玻璃试剂瓶中 | |
| B. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| C. | 少量的钠保存在煤油或石蜡油中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
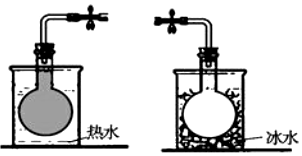 在密封的烧瓶中充入一定量的NO2,发生可逆反应:2NO2?N2O4.不同温度下烧瓶中气体的颜色深浅如图所示.下列有关说法正确的是( )
在密封的烧瓶中充入一定量的NO2,发生可逆反应:2NO2?N2O4.不同温度下烧瓶中气体的颜色深浅如图所示.下列有关说法正确的是( )| A. | 该反应的正反应为吸热反应 | |
| B. | 反应达到平衡时,再充入少量NO2,平衡后NO2的转化率增大 | |
| C. | 反应达到平衡时,再充入少量N2O4,气体颜色变浅 | |
| D. | 反应达到平衡时,增大压强,平衡向正反应方向移动,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
A、B、C是单质,其中A是金属,各种物质间的转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含少量Br2的CCl4中加NaOH溶液,充分振荡,上下两层均为无色 | |
| B. | 向pH试纸上滴加氯水,先变红后变白 | |
| C. | 将红热的铜丝伸入到盛有氯气的集气瓶中,产生蓝绿色的烟 | |
| D. | 往氯水中加入NaHCO3固体,有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝投入稀硝酸中:Cu+4 H++NO3-=Cu2++NO2↑+2H2O | |
| B. | 浓盐酸与MnO2反应制取氯气:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑ | |
| D. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
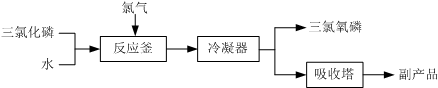
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com