
| ���� | �۵�/�� | �е�/�� |
| 1-���� | -89.5 | 117.3 |
| 1-�嶡�� | -112.4 | 101.6 |
| ���� | -95.3 | 142.4 |
| 1-��ϩ | -185.3 | -6.5 |
���� ��1�����ݷ�������ԭ������������в�������ͨˮʱ������Ч���Ϻã�
��2��l-������Ũ����������£��ɷ������Ӽ�ͷ�������ˮ��
��3�����ݺ�������ǵ����ã����з��ӽṹ�ͻ�ѧ��ɷ�����
��4������1-�嶡��ķе�Ϊ101.6����
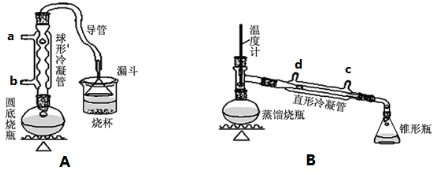
��� �⣺��1����������©���л������ã������ܳ�ֱ������ҷ�ֹ�����������ܲ�������ͨˮ������Ч���Ϻã�����Aװ������ˮ��bͨ�룬Bװ������ˮ��cͨ�룬
�ʴ�Ϊ���ȿ������ճ�֣��ֿ��Է�ֹ������b��c��
��2��l-������Ũ����Ĵ������·�����������ˮ��ȡ��ϩ�����Ӽ���ˮ�õ��ѣ��������Ӽ���ˮ�γ���CH3CH2CH2CH2OCH2CH2CH2CH3����������ˮ��������ϩCH2=CHCH2CH3��ͬʱ�������ӱ�Ũ�����������嵥�ʣ������Ʊ������У������Ũ�������ȱ������ϡ�͵�Ŀ���ǣ����ٸ�����ϩ���ѵ����ɡ�����Br2�����ɣ���ab��ȷ��
�ʴ�Ϊ��ab��
��3������������������ʶԲ�ͬ�����ĺ��������������ԣ����з��ӽṹ�ͻ�ѧ��ɷ���������CH3CH2CH2CH2BrҲ����-CH2CH2CH2CH3�����Բ���ͨ�������������ȷ�����������Ƿ���ڶ��ѣ�CH3CH2CH2CH2OCH2CH2CH2CH3����
�ʴ�Ϊ��������������1-�嶡��Ҳ����-CH2CH2CH2CH3��
��4���ᴿ1-�嶡�飬�ռ��������Ϊ1-�嶡�飬�����뽫1-�嶡������������Һ�����������¶ȴ���е㣬1-�嶡��ķе�Ϊ101.6�棬��ʵ����ҪѸ�������¶���101.6���ռ��������
�ʴ�Ϊ��101.6�森
���� ���⿼�����Ʊ���������ƣ���Ŀ�Ѷ��еȣ���ȷʵ��Ŀ�ġ�ʵ��ԭ��Ϊ���ؼ���ע�������Ʊ�������������۵�ԭ������������ѧ���ķ�����������ѧʵ��������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | NaOH��Һ�����mL�� | ��������������mL�� |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
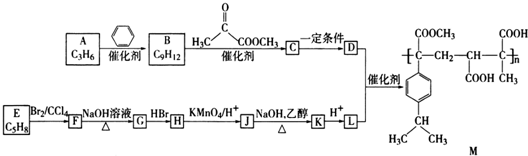
��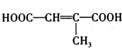 ��д�ṹ��ʽ����
��д�ṹ��ʽ����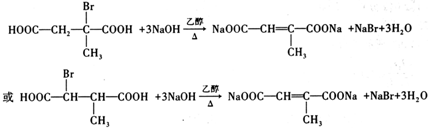 ��
��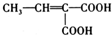 ��д�ṹ��ʽ����
��д�ṹ��ʽ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
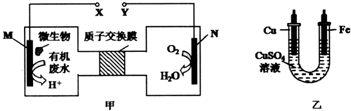
| A�� | ͭ�缫Ӧ��X������ | |
| B�� | H+�����ӽ���Ĥ���������ƶ� | |
| C�� | M�缫��ӦʽΪCO��NH2��2+H2O-6e-�TCO2��+N2��+6H+ | |
| D�� | ��N�缫����0.25 mol����ʱ�������������缫����32 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | ��Է� ������ | ��״ | �۵� | �е� | �ܶ� | �ܽ�� | ||
| ˮ | �Ҵ� | ���� | ||||||
| �ױ� | 92 | ��ɫҺ����ȼ�ӷ� | -95 | 110.6 | 0.8669 | ���� | ���� | ���� |
| ������ | 122 | ��ɫƬ״����״���� | 122.4 | 248 | 1.2659 | �� | ���� | ���� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ij�¶���ˮ�����ӻ�����ΪKw���ڸ��¶��£�a mol•L-1һԪ��HA��b mol•L-1һԪ��BOH�������ϣ���Һ�����ԣ�����Һ��c��H+��=$\sqrt{Kw}$ | |
| B�� | ��֪MgCO3��Ksp=6.82��10-6mol2•L-2�����ں��й���MgCO3��Na2CO3��Һ�У���c��Mg2+��=c��CO32-������c��Mg2+��•c��CO32-��=6.82��10-6mol2•L-2 | |
| C�� | Ksp��AB2��С��Ksp��CD����˵��AB2���ܽ��С��CD���ܽ�� | |
| D�� | NH4Cl��NH3•H2O�Ļ����Һ�У��ֱ����NH4+��ˮ��ƽ���NH3•H2O�ĵ���ƽ�⣬���߶ԶԷ���ƽ�ⶼ���˴ٽ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��̼�����������������������NaCl��Һ����ʼԼ20���������������ɫ���ǣ�Ȼ��ʼ���ֻ���ɫ���ǣ�������ɽ϶�ĺ��ɫ����������˵����ȷ���ǣ�������
��̼�����������������������NaCl��Һ����ʼԼ20���������������ɫ���ǣ�Ȼ��ʼ���ֻ���ɫ���ǣ�������ɽ϶�ĺ��ɫ����������˵����ȷ���ǣ�������| A�� | �����缫��Ӧʽ��Fe-3e-�TFe3+ | |
| B�� | ˮ������������ɫ������ΪNaCl���� | |
| C�� | ����ɫ������Fe��OH��2 | |
| D�� | ���ŵ��Ľ��У���Һ�������Ա�ɼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
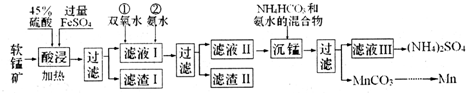
| ���� | Mn��OH��2 | Fe��OH��2 | Fe��OH��3 | Al��OH��3 |
| Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
�鿴�𰸺ͽ���>>
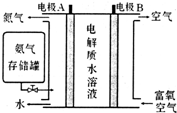
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol����1molCl2��ַ�Ӧ��ת�Ƶ�����Ϊ3NA | |
| B�� | ���³�ѹ�£�2gD216O �к������������������������������ | |
| C�� | 14g ����ʽΪCnH2n �ģ�n��2�������к��е�C=C ����Ŀһ��Ϊ$\frac{{N}_{A}}{n}$ | |
| D�� | �ں�Al3+����ΪNA��AlCl3��Һ�У�Cl-����Ϊ3NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com