
| A. | Y2为0.15mol/L | B. | Z为0.2mol/L | C. | X2为0.3mol/L | D. | Z为0.4mol/L |
分析 分别利用极值法、三段式列式计算出X2、Y2、Z的物质的量浓度的范围,由于为可逆反应,物质不能完全转化,然后根据计算结果对各选项进行判断即可.
解答 解:若反应向正反应方向进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
反应的方程式:X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应向逆反应方向进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
反应的方程式:X2(气)+Y2(气)?2Z(气),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化,
所以平衡时浓度范围为0<c(X2)<0.2,0.2<c(Y2)<0.4,0<c(Z)<0.4,只有B正确,
故选B.
点评 本题考查了化学平衡的计算,题目难度不大,明确可逆反应特点为解答关键,注意掌握化学平衡及其影响,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H+) | B. | c(H+)>c(OH-) | ||
| C. | 2 c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) | D. | c(OH-)+c(S2-)=c(H+)+c(HS-)+2 c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
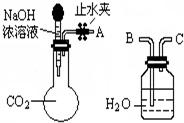 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中 Cl-、$NO_3^-$、Na+、$SO_3^{2-}$ | |
| B. | c(H+)=1.0×10-13mol•L-1溶液中 ${C_6}{H_5}{O^-}$、K+、$SO_4^{2-}$、Br- | |
| C. | Na2S溶液中 $SO_4^{2-}$、K+、Cl-、Cu2+ | |
| D. | pH=12的溶液中 $NO_3^-$、I-、Na+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中存在电离平衡:(NH4)2SO4?2NH4++SO42- | |
| B. | 向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大 | |
| C. | 加水稀释,溶液中所有离子的浓度均减小 | |
| D. | 溶液中:c(SO42-)=2c(NH4+)+2c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com